题目内容
根据如表的数据,判断下列说法正确的是( )
| 离子化合物 | 离子电荷数 | 晶格能 kJ?mol-1 | 熔点 °C | 莫氏硬度 |
| NaF | 1 | 923 | 993 | 3.2 |
| NaCl | 1 | 786 | 801 | 2.5 |
| MgO | 2 | 3791 | 2852 | 6.5 |
| CaO | 2 | 3401 | 2614 | 4.5 |
| A、晶格能的大小与正负离子电荷数和距离成正比 |
| B、NaF晶体比NaCl晶体稳定 |
| C、表中物质CaO的晶体最稳定 |
| D、晶格能就是正负离子间的静电引力,晶格能越大,晶体的熔点越高,硬度越大 |
考点:不同晶体的结构微粒及微粒间作用力的区别
专题:化学键与晶体结构
分析:根据表中的数据可知,晶格能主要影响因素是离子电荷,电荷越高,晶格能越大,而且熔点越高,硬度越大;其次就是离子半径,离子半径越小,晶格能越大,而且熔点越高,硬度越大.
A.晶格能的大小与正负离子电荷数成正比,与距离成反比;
B.晶格能越大,晶体越稳定;
C.表中物质MgO的晶格能最大,晶体最稳定;
D.晶格能越大,即正负离子间的静电作用力越强.
A.晶格能的大小与正负离子电荷数成正比,与距离成反比;
B.晶格能越大,晶体越稳定;
C.表中物质MgO的晶格能最大,晶体最稳定;
D.晶格能越大,即正负离子间的静电作用力越强.
解答:
解:A.根据表中的数据可知,NaF电荷数1,MgO电荷数2,晶格能的大小与正负离子电荷数成正比,MgO、CaO中所带电荷相同,但镁离子半径小于钙离子半径,键长MgO小于CaO,晶格能:MgO>CaO,所以晶格能的大小与距离成反比,故A错误;
B.NaF晶体与NaCl晶体,两种化合物所带离子电荷相同,由于离子半径:Cl->F-,因此晶格能:NaF>NaCl>,NaF晶体比NaCl晶体稳定,故B正确;
C.MgO、CaO中所带电荷相同为2,但镁离子半径小于钙离子半径,NaF晶体与NaCl晶体中阴阳离子所带电荷都为1,离子半径:Cl->F-,所以NaF、NaCl、MgO、CaO4种离子晶体熔点从高到低的顺序是MgO>CaO>NaF>NaCl,晶格能越大,晶体越稳定,表中物质MgO的晶体最稳定,故C错误;
D.离子键本质是阴、阳离子间的静电作用,不只是引力,还有斥力等,晶格能越大,即正负离子间的静电作用力越强,晶体的熔点就越高,硬度越大,故D错误.
故选B.
B.NaF晶体与NaCl晶体,两种化合物所带离子电荷相同,由于离子半径:Cl->F-,因此晶格能:NaF>NaCl>,NaF晶体比NaCl晶体稳定,故B正确;
C.MgO、CaO中所带电荷相同为2,但镁离子半径小于钙离子半径,NaF晶体与NaCl晶体中阴阳离子所带电荷都为1,离子半径:Cl->F-,所以NaF、NaCl、MgO、CaO4种离子晶体熔点从高到低的顺序是MgO>CaO>NaF>NaCl,晶格能越大,晶体越稳定,表中物质MgO的晶体最稳定,故C错误;
D.离子键本质是阴、阳离子间的静电作用,不只是引力,还有斥力等,晶格能越大,即正负离子间的静电作用力越强,晶体的熔点就越高,硬度越大,故D错误.
故选B.
点评:本题考查晶格能的大小比较,题目难度中等,根据表中的数据掌握晶格能的影响因素是解题的关键,注意主要、其次、再次的影响因素的影响大小.

练习册系列答案
相关题目
下列说法错误的是( )
| A、在1个CsCl晶胞中含有1个Cs+ |
| B、SO2在水中的溶解度比CO2在水中的溶解度要大 |
| C、X、Y元素同周期,且电负性X>Y,第一电离能可能Y大于X |
| D、根据电子排布的特点,Cu和Ga在周期表中都属于d 区 |
实验室要用98%的浓硫酸(密度为1.84g?ml-1)配制0.5mol?L-1硫酸溶液480ml,选用的主要仪器有烧杯、胶头滴管、玻璃棒、量筒,还缺少( )
| A、容量瓶 |
| B、250ml容量瓶 |
| C、分液漏斗 |
| D、500ml容量瓶 |
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如表数据(盐酸的物质的量浓度相等),下列分析推理正确的是( )
| 30mL盐酸 | 30mL盐酸 | 30mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A、向50 mL盐酸中加入混合物27.6 g时,盐酸过量 |
| B、根据表中数据不能计算出混合物中NaHCO3的质量分数 |
| C、15.7 g混合物与盐酸恰好能完全反应 |
| D、盐酸的物质的量浓度为5.0 mol/L |
25℃时,10mL 0.1mol.L-1NH4Cl溶液中存在平衡:NH4++H2O?NH3?H2O+H+.对于该平衡,下列叙述正确的是( )
| A、加入大量水稀释时,平衡向右移动,溶液中c(H+)减小 |
| B、加入几滴浓盐酸,平衡向左移动,溶液的pH值增大 |
| C、加入几滴浓氨水,平衡向逆反应方向移动,c(OH-)减小 |
| D、升温至35℃,平衡向右移动,NH4Cl的水解程度减小 |

 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请完成以下问题: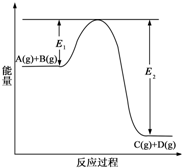 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.