题目内容
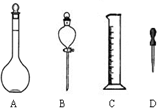
实验室要用98%的浓硫酸(密度为1.84g?ml-1)配制0.5mol?L-1硫酸溶液480ml,选用的主要仪器有烧杯、胶头滴管、玻璃棒、量筒,还缺少( )
| A、容量瓶 |
| B、250ml容量瓶 |
| C、分液漏斗 |
| D、500ml容量瓶 |
考点:不能加热的仪器及使用方法
专题:
分析:操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,根据配制一定物质的量浓度的溶液的操作步骤选择仪器.
解答:
解:操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,用量筒量取(用到胶头滴管)浓硫酸,在烧杯中稀释,用玻璃棒搅拌,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,将洗涤液转移到容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,
由提供的仪器可知还需要仪器有:500mL容量瓶.
故选D.
由提供的仪器可知还需要仪器有:500mL容量瓶.
故选D.
点评:本题考查配制一定物质的量浓度的溶液中选用仪器的方法,题目难度中等,注意掌握物质的量浓度与溶质质量分数之间的转化,明确配制一定物质的量浓度的溶液方法及选用仪器规格的原则.

练习册系列答案
相关题目
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
根据如表的数据,判断下列说法正确的是( )
| 离子化合物 | 离子电荷数 | 晶格能 kJ?mol-1 | 熔点 °C | 莫氏硬度 |
| NaF | 1 | 923 | 993 | 3.2 |
| NaCl | 1 | 786 | 801 | 2.5 |
| MgO | 2 | 3791 | 2852 | 6.5 |
| CaO | 2 | 3401 | 2614 | 4.5 |
| A、晶格能的大小与正负离子电荷数和距离成正比 |
| B、NaF晶体比NaCl晶体稳定 |
| C、表中物质CaO的晶体最稳定 |
| D、晶格能就是正负离子间的静电引力,晶格能越大,晶体的熔点越高,硬度越大 |
 某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )| A、a的数值一定大于9 |
| B、Ⅱ为氨水稀释时溶液的pH变化曲线 |
| C、稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
| D、完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水) |
 烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务:
烧杯中装有100mLH2SO4和Na2SO4的混合液,其浓度分别为0.16mol/L和2mol/L,欲使其浓度分别变为1.6mol/L和0.2mol/L,在只有蒸馏水和18mol/L浓H2SO4以及必要仪器的条件下,完成任务: