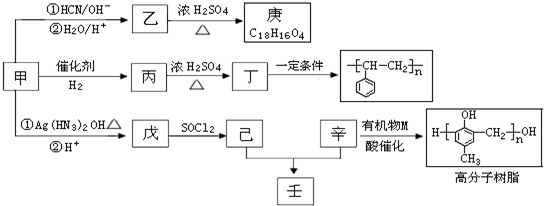
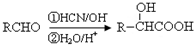
题目内容
欲除去下列各物质中的少量杂质(括号内为杂质),将除去杂质有关反应的化学方程式填入见表:
| 序号 | 混合物 | 化学方程式 |
| (1) | Na2CO3固体(NaHCO3) | |
| (2) | Fe2O3固体(Al2O3) | |
| (3) | NaHCO3溶液(Na2CO3) | |
| (4) | FeCl2溶液(FeCl3) | |
| (5) | CO2(HCl) |
考点:化学方程式的书写
专题:
分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
(1)NaHCO3不稳定,加热易分解,可用加热的方法除杂;
(2)Al2O3为两性氧化物,可与强碱溶液反应,而Fe2O3和强碱不反应;
(3)溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂;
(4)根据亚铁离子和铁离子的不同性质进行分析,注意在除去铁离子的同时不能带入新的杂质;
(5)根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
(1)NaHCO3不稳定,加热易分解,可用加热的方法除杂;
(2)Al2O3为两性氧化物,可与强碱溶液反应,而Fe2O3和强碱不反应;
(3)溶液中Na2CO3能与CO2、H2O反应生成NaHCO3,NaHCO3与CO2不反应,所以可用通入CO2来除杂;
(4)根据亚铁离子和铁离子的不同性质进行分析,注意在除去铁离子的同时不能带入新的杂质;
(5)根据NaHCO3溶液能与HCl气体反应,而不与二氧化碳反应分析;
解答:
解:(1)碳酸钠加热难分解,碳酸氢钠不稳定,加热易分解生成Na2CO3,2NaHCO3
Na2CO3+H2O+CO2↑,可用加热的方法除杂,
故答案为:2NaHCO3
Na2CO3+H2O+CO2↑;
(2)Al2O3为两性氧化物,可与强碱溶液反应,而氧化铁不能,则可用氢氧化钠溶液分离,Al2O3+2NaOH═2NaAlO2+H2O(Al2O3+2OH-═2AlO2-+H2O),
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(3)NaHCO3与CO2不反应,碳酸钠溶液与二氧化碳反应生成生成碳酸氢钠,则通二氧化碳可除杂,化学反应为:Na2CO3+H2O+CO2=2NaHCO3,
故答案为:Na2CO3+H2O+CO2=2NaHCO3;
(4)加铁粉发生2FeCl3+Fe═3FeCl2(2Fe3++Fe═3Fe2+),除去了杂质,生成主体物质,
故答案为:2FeCl3+Fe═3FeCl2;
(5)NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,HCl+NaHCO3═NaCl+H2O+CO2↑(H++HCO3-=H2O+CO2↑),在除去氯化氢的同时增加了二氧化碳的量,
故答案为:HCl+NaHCO3═NaCl+H2O+CO2↑;
| ||
故答案为:2NaHCO3
| ||
(2)Al2O3为两性氧化物,可与强碱溶液反应,而氧化铁不能,则可用氢氧化钠溶液分离,Al2O3+2NaOH═2NaAlO2+H2O(Al2O3+2OH-═2AlO2-+H2O),
故答案为:Al2O3+2NaOH═2NaAlO2+H2O;
(3)NaHCO3与CO2不反应,碳酸钠溶液与二氧化碳反应生成生成碳酸氢钠,则通二氧化碳可除杂,化学反应为:Na2CO3+H2O+CO2=2NaHCO3,
故答案为:Na2CO3+H2O+CO2=2NaHCO3;
(4)加铁粉发生2FeCl3+Fe═3FeCl2(2Fe3++Fe═3Fe2+),除去了杂质,生成主体物质,
故答案为:2FeCl3+Fe═3FeCl2;
(5)NaHCO3溶液能与盐酸反应生成氯化钠、水和二氧化碳,HCl+NaHCO3═NaCl+H2O+CO2↑(H++HCO3-=H2O+CO2↑),在除去氯化氢的同时增加了二氧化碳的量,
故答案为:HCl+NaHCO3═NaCl+H2O+CO2↑;
点评:本题考查物质的分离与除杂,为高考常见题型,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键,难度不大.

练习册系列答案
相关题目
如图实验装置或操作与微粒的大小无直接关系的是( )
A、 过滤 |
B、 渗析 |
C、 萃取 |
D、 丁达尔效应 |
下列表达方式正确的是( )
| A、乙烯的结构简式CH2CH2 |
B、基态氧原子L层电子排布图: |
C、甲基的电子式  |
| D、HClO的结构式:H-Cl-O |
在一定密闭容器中,反应aA(g)═bB(g)达平衡后,保持温度及各物质的量不变,将容器体积增加1倍,当达到新平衡时,B的浓度是原来的60%,则下列说法不正确的是( )
| A、平衡向正反应方向移动了 |
| B、物质A的转化率减少了 |
| C、容器体积增加可以是向其中充入了惰性气体 |
| D、a<b |
根据如表的数据,判断下列说法正确的是( )
| 离子化合物 | 离子电荷数 | 晶格能 kJ?mol-1 | 熔点 °C | 莫氏硬度 |
| NaF | 1 | 923 | 993 | 3.2 |
| NaCl | 1 | 786 | 801 | 2.5 |
| MgO | 2 | 3791 | 2852 | 6.5 |
| CaO | 2 | 3401 | 2614 | 4.5 |
| A、晶格能的大小与正负离子电荷数和距离成正比 |
| B、NaF晶体比NaCl晶体稳定 |
| C、表中物质CaO的晶体最稳定 |
| D、晶格能就是正负离子间的静电引力,晶格能越大,晶体的熔点越高,硬度越大 |
 某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )
某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示.据图判断错误的是( )| A、a的数值一定大于9 |
| B、Ⅱ为氨水稀释时溶液的pH变化曲线 |
| C、稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大 |
| D、完全中和相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V(NaOH)<V(氨水) |