题目内容
4.一定质量的混合气体在密闭容器中发生如下反应:xA(气)+yB(气)?zC(气).达到平衡后,测得A气体的浓度为0.5mol/L.当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.3mol/L.下列叙述正确的是( )| A. | 平衡向正反应方向移动 | B. | x+y>z | ||
| C. | C的体积分数增大 | D. | B的转化率增大 |
分析 保持温度不变,将容器的体积扩大一倍,如平衡不移动,A的浓度为0.25mol/L,小于实际A的浓度变为0.3mol/L,说明平衡向生成A的方向移动,即向逆反应移动,据此结合选项解答.
解答 解:A、由上述分析可知,平衡向逆反应移动,故A错误;
B、增大体积,压强减小,平衡向逆反应移动,压强减小平衡向气体物质的量增大的方向移动,即x+y>z,故B正确;
C、平衡向逆反应移动,减小压强平衡向气体物质的量增大的方向移动,气体的物质的量增大,C物质的量减小,故C的体积分数下降,故C错误;
D、平衡向逆反应方向移动,B的转化率降低,故D错误;
故选B.
点评 本题考查化学平衡移动,难度中等,利用假设法判断平衡移动方向是解题关键.

练习册系列答案
相关题目
3.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
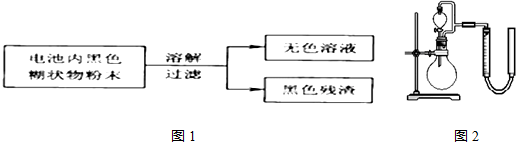
(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图2所示.将等物质的量浓度、等体积H2O2溶液加入烧瓶中,分别进行2个实验(气体的体积在相同条件下测定).
实验1、2中参加反应的H2O2的物质的量之比为1:1,实验二中反应的离子方程式为H2O2+2H++MnO2═Mn2++2H2O+O2↑.

(1)锌锰干电池的电路中每通过0.2mole-,理论上负极质量减少6.5g;工作时NH4+离子在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
(2)某研究小组对电池内黑色糊状物进行了下列实验.
已知:Zn(OH)2是两性氢氧化物.完成下列实验报告.
| 实验步骤 | 实验现象 | 实验结论和解释 |
| 取少量上述无色溶液于试 管中,逐滴加入NaOH溶液,直至过量,再加热 | 生成白色沉淀,白色沉淀逐渐溶解,产生刺激性气味的气体 | 无色溶液中存在Zn2+、NH4+离子 检验NH4+离子存在的离子方程式是将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口;红色石蕊试纸变蓝 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2和稀硫酸 | 黑色粉末部分溶解, 收集到112mL气体 | MnO2做氧化剂,生成Mn2+离子 |
4.工业上通过反应“SiO2(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$Si(s)+2CO”制取单质硅,下列说法正确的是( )
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
19.下列叙述不正确的是( )
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
9.化学与生产、生活和社会密切相关.下列说法正确的是( )
| A. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 | |
| B. | 二氧化硫、氮氧化物和可入肺颗粒物是雾霾的主要成分,PM2.5就是指大气中直径小于或等于2.5微米的可入肺颗粒物 | |
| C. | 屠呦呦最早提出用乙醚提取青蒿,其提取物抗疟作用达95%到100%,这种提取原理就是蒸馏,属于物理过程 | |
| D. | 不锈钢具有较强的抗腐蚀性,是因为在钢铁表面镀上了金属铬 |
13.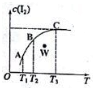 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
 将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )
将I2溶于KI溶液中,能配制成浓度较大的碘水,主要是发生了反应:I2(aq)+I-(aq)?I3-(aq),该平衡体系中,I2的物质的量浓度与温度(T)的关系如图所示(曲线上的任何一点都代表平衡状态),下列说法正确的是( )| A. | 正反应为吸热反应 | B. | 平衡常数:KA>KB | ||
| C. | 反应速率:vB>vC | D. | W点时,v正>v逆 |
14.镍有电镀和化学镀两种方法,化学镀反应原理:Ni2++H2PO2-+H2O═Ni+H2PO3-+2H+.下列说法错误的是( )
| A. | 电镀镍时,Ni为阴极,镀件为阳极 | |
| B. | 电镀和化学镀原理都是利用氧化还原反应 | |
| C. | 化学镀无需通电,对镀件的导电性无特殊要求 | |
| D. | 化学镀中H2PO2-中P化合价为+1,有强还原性 |