题目内容
7.某恒温密闭容器中,可逆反应A(s)?B+C(g)△H=+Q kJ•mol-1(Q>0)达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗﹕n(C)消耗=1﹕1 | |
| C. | 若开始时向容器中加入1molB和1molC,达到平衡时放出热量等于Q kJ | |
| D. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 |
分析 A、若B为气体,且原平衡时B与C的浓度相等时,因容器保持恒温,缩小容器体积,达到新平衡时平衡常数不变,则气体C的浓度也一定不变;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗;
C、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时不能完全消耗,放出热量小于Q;
D、保持体积不变,向平衡体系中加入A,A为固体,则平衡不动.
解答 解:A、若B是气体,平衡常数K=c(B)•c(C),若B是非气体,平衡常数K=c(C),由于C(g)的浓度不变,因此B可以是非气体,故A错误;
B、平衡时,各物质的量不再改变,正反应速率和逆反应速率相等,因此单位时间内n(A)消耗=n(C)消耗,故B正确;
C、因反应为可逆反应,故加入1molB和1molC至反应达到平衡时转化率一定小于100%,因此放出热量小于Q,故C错误;
D、保持体积不变,向平衡体系中加入A,A为固体,则平衡不动,故D错误;
故选:B.
点评 本题考查化学平衡影响因素的分析判断,化学判断移动原理的理解设计解题关键,题目难度中等.

练习册系列答案
相关题目
7.四种多硼酸根离子的结构示意图如下,有关叙述正确的是( )


| A. | x=2 | B. | y=3 | ||
| C. | z=4 | D. | 图(d)的化学式为BO2 |
4.工业上通过反应“SiO2(s)+2C(s)$\frac{\underline{\;高温\;}}{\;}$Si(s)+2CO”制取单质硅,下列说法正确的是( )
| A. | 自然界中硅元素均以SiO2形式存在 | |
| B. | 高纯度晶体Si可用于制造光导纤维 | |
| C. | 该反应条件下C的还原性比Si强 | |
| D. | 生成4.48LCO时转移电子数为0.4×6.02×1023 |
19.下列叙述不正确的是( )
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
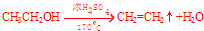 .
.