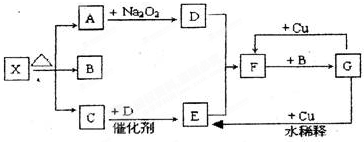
题目内容
某NaHCO3和Na2CO3?xH2O混合物40g,在200℃下,对其加热不再产生气体为止,得到固体21.2g.再把加热过程中产生的气体全部通入含有0.05mol Ca(OH)2的溶液中,恰好使生成的沉淀完全消失,则x为 .
考点:化学方程式的有关计算
专题:
分析:加热时NaHCO3和Na2CO3?xH2O发生反应2NaHCO3
Na2CO3+CO2↑+H2O、Na2CO3.xH2O
Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3
Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=
=0.2mol,除去碳酸氢钠得到的就是Na2CO3?xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3
Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3?xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=
=0.7mol,根据Na2CO3?xH2O
Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,从而确定x值.
| ||
| ||
根据2NaHCO3
| ||
| 21.2g |
| 106g/mol |
根据2NaHCO3
| ||
则Na2CO3?xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=
| 12.6g |
| 18g/mol |
| ||
解答:
解:加热时NaHCO3和Na2CO3?xH2O发生反应2NaHCO3
Na2CO3+CO2↑+H2O、Na2CO3.xH2O
Na2CO3+xH2O,加热后得到的固体是Na2CO3,只有NaHCO3生成二氧化碳,二氧化碳和 Ca(OH)2反应方程式为Ca(OH)2+2CO2=Ca(HCO3)2,根据Ca(OH)2+2CO2=Ca(HCO3)2得n(CO2)=2n[Ca(OH)2]=0.05mol×2=0.1mol,
根据2NaHCO3
Na2CO3+CO2↑+H2O 得碳酸氢钠生成的n[Na2CO3]=n(CO2)=0.1mol,最终得到的固体中n(Na2CO3)=
=0.2mol,除去碳酸氢钠得到的就是Na2CO3?xH2O得到n(Na2CO3)=0.2mol-0.1mol=0.1mol,
根据2NaHCO3
Na2CO3+CO2↑+H2O得反应前后固体减少的质量=n(H2CO3).M(H2CO3)=n(CO2).M(H2CO3)=0.1mol×62g/mol=6.2g,
则Na2CO3?xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=
=0.7mol,根据Na2CO3?xH2O
Na2CO3+xH2O得n(H2O)=xn(Na2CO3)=0.1xmol,0.1xmol=0.7mol,x=7,
故答案为:7.
| ||
| ||
根据2NaHCO3
| ||
| 21.2g |
| 106g/mol |
根据2NaHCO3
| ||
则Na2CO3?xH2O反应前后固体减少质量=40g-21.2g-6.2g=12.6g,水的物质的量=
| 12.6g |
| 18g/mol |
| ||
故答案为:7.
点评:本题考查根据方程式的计算,侧重考查分析、计算能力,利用质量差、物质的量进行有关计算,明确各个物理量之间的关系,题目难度中等.

练习册系列答案
相关题目
下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
| A、在0.1 mol?L-1 NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B、在0.1 mol?L-1 Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C、向0.2 mol?L-1 NaHCO3溶液中加入等体积0.1 mol?L-1 NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、CH3COONa和CH3COOH混合溶液一定存在:c(Na+)=c(CH3COO-)=c(CH3COOH)>c(H+)=c(OH-) |
根据如图,下列判断中正确的是( )
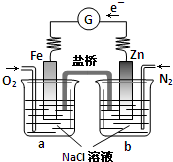

| A、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH降低 |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、烧杯b中发生反应为Zn-2e-=Zn2+ |
下列离子方程式中,正确的是( )
| A、氯气通入水中,溶液呈酸性:Cl2+H2O?2H++Cl-+ClO- | ||||
B、用铜做电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| C、NaHS电离方程式:NaHS?Na++HS- | ||||
| D、NH4Cl水解反应:NH4++2H2O?NH3?H2O+H3O+ |
下列各组反应中最终肯定有白色沉淀的是( )
| A、向饱和碳酸钠溶液中通入过量CO2 |
| B、氯化亚铁溶液中加入少量过氧化钠 |
| C、AlCl3溶液中加入过量氢氧化钠溶液 |
| D、氯化钙溶液中通入过量CO2 |

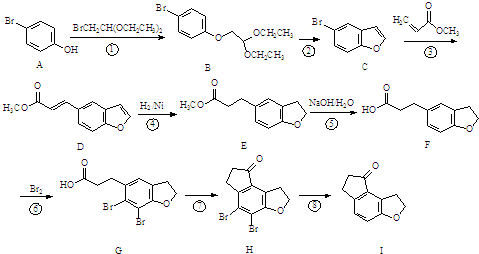
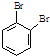 为原料,合成
为原料,合成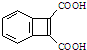 ,写出合成流程图(无机试剂任用).合成
,写出合成流程图(无机试剂任用).合成