题目内容
5.下列对一些实验事实及其理论解释都正确的是( )| 选项 | 实验事实 | 理论解释 |
| A | Be原子的第一电离能小于B原子 | 同周期元素原子的电离能随原子序数增大而增大 |
| B | CH4为正四面体形分子 | CH4分子中C为sp3杂化,键角为109°28′ |
| C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
| D | HF的沸点高于HCl | HF分子间能形成氢键,HCl不能 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、Be原子的价电子排布为2s2全满状态,能量最低,所以Be原子的第一电离能大于B原子;
B、CH4中价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化;
C、金刚石属于原子晶体,石墨属于混合晶体;
D、从HF分子中含有氢键角度分析.
解答 解:A、Be原子的价电子排布为2s2全满状态,能量最低,所以Be原子的第一电离能大于B原子,而不是小于B原子,故A错误;
B、CH4中价层电子对个数=4+$\frac{1}{2}$×(4-4×1)=4,所以C原子采用sp3杂化,所以CH4为正四面体形分子,故B正确;
C.金刚石是原子晶体,石墨属于混合晶体,故C错误;
D.理论解释不对,HF分子中含有氢键,故HF的沸点高于HCl,故D正确.
故选BD.
点评 本题考查物质结构与性质知识,题目难度不大,注意把握Be原子的第一电离能大于B原子的原因.

练习册系列答案
相关题目
15.化学与生活、社会发展息息相关,下列有关说法或做法不正确的是( )
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 | |
| C. | 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”;这是利用了“焰色反应” | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
16.与元素的化学性质关系最密切的是( )
| A. | 电子层数 | B. | 最外层电子数 | C. | 核电荷数 | D. | 中子数 |
13.化学与我们人类生活息息相关,下列说法不正确的是( )
| A. | 开发氢能、太阳能、风能、生物质能等是实现“低碳生活”的有效途径 | |
| B. | 工业上,电解熔融MgCl2制金属镁 | |
| C. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| D. | “冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
20.下列化学用语表示正确的是( )
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式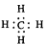 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |
10.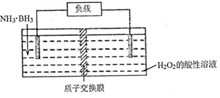 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
 氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )
氨硼烷(NH3•BH3)电池可在常温下工作,装置如图所示.该电池工作时的总反应为:NH3•BH3+3H2O2=NH4BO2+4H2O.下列说法正确的是( )| A. | 负极附近溶液的PH增大 | |
| B. | 正极的反应式为:H2O2+2H++2e-=2H2O | |
| C. | 电池工作时,BO2-通过质子交换膜向正极移动 | |
| D. | 消耗3.lg氨硼烷,理论上转移0.2mol电子 |
17.如图是化学反应中物质变化和能量变化的示意图.若E1>E2,则下列反应符合该示意图的是( )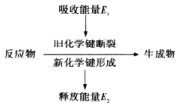

| A. | NaOH溶液与稀盐酸的反应 | B. | 锌与稀盐酸的反应 | ||
| C. | 氢氧化钡与氯化铵固体的反应 | D. | 一氧化碳在空气中的燃烧反应 |
14.下列化学用语或物质结构的表述正确的是( )
| A. | 中子数为10 的氧原子:10O | |
| B. | 过氧化氢的电子式:H-O-O-H | |
| C. | CS2中各原子最外层都满足8 电子结构 | |
| D. | CH2Cl2是四面体构型的含非极性健的分子 |
10.下列说法不正确的是( )
| A. | HF比H2O稳定性更强,是由于HF分子间作用力较大 | |
| B. | CC14、N2和SiO2晶体中,各原子最外层都达到8电子稳定结构 | |
| C. | Na投入到水中,有共价键的断裂与形成 | |
| D. | 离子化合物中一定含有离子键,可能含有共价键 |