题目内容
10.常温下,下列溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1 mol•L-1 CH3COONa溶液与0.1 mol•L-1 CaCl2溶液等体积混合:c(Na+)+c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-) | |
| B. | 少量Cl2通入过量泠的0.1 mol•L-1 NaOH溶液中:c(Na+)═c(HClO)+c(ClO-)+c(Cl-) | |
| C. | 0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合至pH=7:c(Na+)>c(Cl-)═c(CH3COOH) | |
| D. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1 HCl溶液等体积混合:c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-) |
分析 A、根据物料守恒可知:c(Na+)═c(CH3COO-)+c(CH3COOH),2c(Ca2+)═c(Cl-);
B、如果两者恰好完全反应生成氯化钠和次氯酸钠,符合:c(Na+)═c(HClO)+c(ClO-)+c(Cl-);
C、0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合,溶液中钠离子和氯离子的物质的量相等;
D、根据电荷守恒可知:c(Cl-)+c(OH-)=c(H+)+c(NH4+),由物料守恒可知:c(NH3•H2O)+c(NH4+)=2c(Cl-),由此分析解答.
解答 解:A、根据物料守恒可知:c(Na+)═c(CH3COO-)+c(CH3COOH),2c(Ca2+)═c(Cl-),所以c(Na+)+2c(Ca2+)═c(CH3COO-)+c(CH3COOH)+c(Cl-),故A错误;
B、如果两者恰好完全反应生成氯化钠和次氯酸钠,符合:c(Na+)═c(HClO)+c(ClO-)+c(Cl-),而氢氧化钠过量,所以c(Na+)>c(HClO)+c(ClO-)+c(Cl-),故B错误;
C、0.1 mol•L-1CH3COONa溶液与0.1 mol•L-1 HCl溶液混合,溶液中钠离子和氯离子的物质的量相等,所以c(Na+)=c(Cl-)>c(CH3COOH),故C错误;
D、根据电荷守恒可知:c(Cl-)+c(OH-)=c(H+)+c(NH4+)…①,由物料守恒可知:c(NH3•H2O)+c(NH4+)=2c(Cl-)…②,由①-②可知::c(Cl-)+c(H+)═c(NH3•H2O)+c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,弱电解质的电离平衡、盐类的水解、溶液中离子浓度大小的比较,比较难的是离子浓度大小的比较,可根据物料守恒、电荷守恒进行分析判断.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案| A. | 原子半径:X>Y>Z>W | B. | 单质沸点:W>Y>Z | ||
| C. | 简单氢化物的还原性:Y>Z>W | D. | W、X、Z的离子均能促进水的电离 |
| 难容电解质 | AgCl | AgBr | Agl | Ag2SO4 | Ag2CrO4 |
| Ksp | 1.8×10-10 | 5.4×10-13 | 8.5×10 -17 | 1.4×10-5 | 1.12×10-12 |
| A. | 由溶度积常数可以判断相应物质的溶解性大小 | |
| B. | 将等体积的 4×10-3 mol/L 的 AgNO3 溶液和 4×10-3 mol/L K2CrO4溶液混合,有 Ag2CrO4沉淀产生 | |
| C. | 向 AgCl 的悬浊液中滴加饱和 NaBr 溶液不能得到黄色 AgBr | |
| D. | 向 100 mL 0.02mol/L 的 NaSO4 溶液中加入 100mL0.02mol/L 的 AgNO3 溶液,有白色沉淀生成 |
| CH3COOH | HC1O | H2CO3 |
| Ka=1.8×l0-5 | Ka=3.0×l0-8 | Ka1=4.4×l0-7Ka2=4.7×l0-11 |
| A. | 向NaClO溶液中通入少量CO2的离子方程式为:2C1O-+CO2+H2O═2HC1O+CO32- | |
| B. | 相同浓度的CH3COOH和NaClO的混合溶液中,水的电离程度前者大 | |
| C. | 向0.lmol•L-l的CH3COOH溶液中滴加NaOH溶液至pH=5,此时溶液的 c(CH3COOH):c(CH3COO-)=5:9 | |
| D. | 常温下,0•lmol•L-1 的 NaHC2O4 溶液 pH=4:c(HC2O4-)>c(H+)>c(H2C2O4)>c(C2O42-) |
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 因患“禽流感”而被捕杀的家禽尸体常用生石灰处理 | |
| C. | 《本草经集注》中记载了区分硝石(KNO3)和朴消(Na2SO4)的方法:“以火烧之,紫青烟起,乃真硝石也”;这是利用了“焰色反应” | |
| D. | 煤经过气化和液化等物理变化可以转化为清洁燃料 |
| A. |  与 与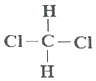 是同分异构体 是同分异构体 | |
| B. | 乙醇、乙酸、乙酸乙酯都能发生取代反应 | |
| C. | 相同质量的烃完全燃烧,耗氧量最小的是CH4 | |
| D. | 乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同 |
| A. | 有机玻璃、涤纶、蚕丝、人造丝都属于高分子化合物 | |
| B. | C5H11Cl有8种同分异构体(不考虑立体异构) | |
| C. | 实验室用苯与浓硝酸在常温下发生硝化反应制备硝基苯 | |
| D. | 通过煤的干馏和石油的催化重整可获得芳香烃 |
| A. | CO2的分子模型示意图: | |
| B. | 甲烷的电子式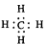 | |
| C. | 硫离子核外电子排布式1s22s22p63s23p4 | |
| D. | 中子数为8的碳原子86C |