��Ŀ����
��ҵ���ð���������Ļ������һ�������������ᣬ�����ķ�Ӧ�ǣ�
��4NH3+5O2��4NO+6H2O
��4NO+3O2+2H2O��4HNO3
��������������������Ϊ0.20�������������Ϊ0.80�������������ռ����㣺
��1��Ϊʹ1mol����ǡ����ȫת����Ϊ���ᣬ�����������������Ϊ ������������Һ������������ ��
��2���ֽ�1mol�İ�����8mol�Ŀ�����Ϸ�Ӧ�����������������������
��4NH3+5O2��4NO+6H2O
��4NO+3O2+2H2O��4HNO3
��������������������Ϊ0.20�������������Ϊ0.80�������������ռ����㣺
��1��Ϊʹ1mol����ǡ����ȫת����Ϊ���ᣬ�����������������Ϊ
��2���ֽ�1mol�İ�����8mol�Ŀ�����Ϸ�Ӧ�����������������������
���㣺��ѧ����ʽ���йؼ���
ר�⣺������
��������1�����ɷ���ʽ�ɵ÷�Ӧ�ܷ���ʽ��NH3+2O2=HNO3+H2O���ݴ�ȷ������������������ȣ�����������Һ��HNO3��H2O�����ʵ���֮��Ϊ1��1���ٽ����������������㣻
��2���������������ʵ������ٸ��ݷ���ʽ4NH3+5O2=4NO+6H2O��4NO+3O2+2H2O=4HNO3����HNO3��H2O�����ʵ������ٽ����������������㣮
��2���������������ʵ������ٸ��ݷ���ʽ4NH3+5O2=4NO+6H2O��4NO+3O2+2H2O=4HNO3����HNO3��H2O�����ʵ������ٽ����������������㣮
���
�⣺��1�����ɷ���ʽ�ɵ÷�Ӧ�ܷ���ʽ��NH3+2O2=HNO3+H2O��Ϊʹ1mol����ǡ����ȫת����Ϊ���ᣬ��Ҫ����Ϊ2mol���ʰ����������������=1mol��2mol=1��2��
����������Һ��HNO3��H2O�����ʵ���֮��Ϊ1��1��������������Һ��������=
��100%=77.8%��
�ʴ�Ϊ��1��2��77.8%��
��2��8mol�Ŀ��������������ʵ���=0.2��8mol=1.6mol����
4NH3+5O2=4NO+6H2O
4 5 4 6
1mol 1.25mol 1mol 1.5mol
ʣ������Ϊ1.6mol-1.25mol=0.35mol
4NO+3O2+2H2O=4HNO3
4 3 2 4
0.35mol n��H2O�� n��HNO3��
n��H2O��=
=
mol��n��HNO3��=
=
mol
��������Һ��ˮ�����ʵ���=1.5mol-
mol=
mol��
��������ˮ�����ʵ���֮��=
mol��
mol=7��19��
������������Һ��������=
��100%=56.32%��
�������������������Ϊ56.32%��
����������Һ��HNO3��H2O�����ʵ���֮��Ϊ1��1��������������Һ��������=
| 1mol��63g/mol |
| 1mol��(63g/mol+18g/mol) |
�ʴ�Ϊ��1��2��77.8%��
��2��8mol�Ŀ��������������ʵ���=0.2��8mol=1.6mol����
4NH3+5O2=4NO+6H2O
4 5 4 6
1mol 1.25mol 1mol 1.5mol
ʣ������Ϊ1.6mol-1.25mol=0.35mol
4NO+3O2+2H2O=4HNO3
4 3 2 4
0.35mol n��H2O�� n��HNO3��
n��H2O��=
| 0.35mol��2 |
| 3 |
| 7 |
| 30 |
| 0.35mol��4 |
| 3 |
| 7 |
| 15 |
��������Һ��ˮ�����ʵ���=1.5mol-
| 7 |
| 30 |
| 38 |
| 30 |
��������ˮ�����ʵ���֮��=
| 7 |
| 15 |
| 38 |
| 30 |
������������Һ��������=
| 7mol��63g/mol |
| 7mol��63g/mol+19mol��18g/mol |
�������������������Ϊ56.32%��
���������⿼�鷽��ʽ���йؼ��㣬��1����ע�������ܷ�Ӧ����ʽ��𣬣�2����ע���������㣬�漰�����������⣬�Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ
��ҵ����̼�ڸ����»�ԭSiO2��ȡ�裬�����30g SiO2��������̼�ڸ����³�ַ�Ӧ����������������ȷ���ǣ�������
| A����Ӧ��������22.4L CO |
| B����Ӧ����12g̼����ԭ |
| C����0.5mol SiO2�μӷ�Ӧ |
| D����Ӧ����0.5��6.02��1023�����ӷ���ת�� |
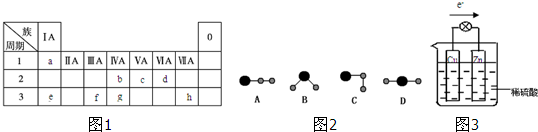
 NO��NO2��SO2��CO�Ⱦ�Ϊ������Ⱦ��о���Щ��������պʹ��������ش���ش��������⣺
NO��NO2��SO2��CO�Ⱦ�Ϊ������Ⱦ��о���Щ��������պʹ��������ش���ش��������⣺
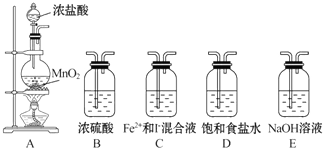
 ��ͼ��ʾװ����ʵ���ҳ��õ�һ����ȡ�����װ�ã�
��ͼ��ʾװ����ʵ���ҳ��õ�һ����ȡ�����װ�ã�