题目内容
10.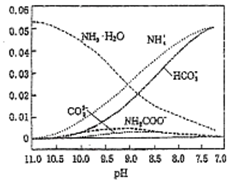 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )| A. | 由图中数据可计算NH4+的水解平衡常数约为1×10-9 | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断增大 | |
| D. | 由图可得离子的水解能力NH4+>HCO3- |
分析 A、由NH4++H2O?NH3•H2O+H+,当PH=9时,所以铵根离子的浓度与一水合氨的浓度相等;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度;
C.根据Kb=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$是一常数,结合平衡移动;
D.由图可PH相同时铵根离子的浓度大于碳酸氢根离子,所以碳酸氢根离子的水解能力强.
解答 解:A、由NH4++H2O?NH3•H2O+H+,当PH=9时,所以铵根离子的浓度与一水合氨的浓度相等,所以K=c(H+)=1×10-9,故A正确;
B.溶液中存在电荷守恒,即正电荷的总浓度等于负电荷的总浓度,则不同pH的溶液中存在电荷守恒关系为:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-),故B正确;
C、已知Kb=$\frac{c(N{H}_{4}^{+})c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,温度一定时,Kb为常数,不随浓度的变化而变化,随着CO2的通入,c(NH4+)逐渐增大,则$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断减小,故C错误;
D.由图可PH相同时铵根离子的浓度大于碳酸氢根离子,所以碳酸氢根离子的水解能力强,则水解能力NH4+<HCO3-,故D错误;
故选AB.
点评 本题考查了溶液中离子浓度大小比较、电荷守恒的应用、图象的分析与应用等,题目难度中等,侧重于考查学生对图象的分析与应用能力.

练习册系列答案
相关题目
20.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Fe3+有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸有腐蚀性 | 常温下浓硫酸不能用铁罐盛装 |
| C | Cl2是非金属单质 | Cl2能使湿润的有色布条褪色 |
| D | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
| A. | A | B. | B | C. | C | D. | D |
1.水是制取H2的常见原料,下列有关说道额说法正确的是( )
| A. | H2O分子中有2个由s轨道与sp3杂化轨道形成的σ键 | |
| B. | 水分子是一种极性分子,水分子空间结构呈直线型 | |
| C. | 冰与干冰都是分子晶体,其晶胞中分子的空间排列方式类似 | |
| D. | 水分子间通过H-O键形成冰晶体 |
5.X、Y、Z、W、M为原子序数依次增大的短周期主族元素.己知:
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
①元素对应的原子半径大小为:X<Z<Y<M<W;
②Y是组成有机物的必要元素
③Z与X可形成两种常见的共价化合物,与W可形成两种常见的离子化合物;
④M的电子层数与最外层电子数相等.
下列说法不正确的是( )
| A. | W、M的离子半径为M<W | |
| B. | YZ2为直线形的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Z与X形成的化合物的熔沸点偏高是因其分子内存在氢键 | |
| D. | Z与M形成的化合物可作为耐高温材料 |
2.下列化学方程式的叙述正确的是( )
| A. | 已知2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
6.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,下列说法正确的是( )
| A. | 在相同条件下,1 mol H2(g)与0.5 mol O2(g)的能量总和大于1 mol H2O(g)的能量 | |
| B. | 标准状况下,1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O放出的热量为241.8 kJ | |
| C. | 8 g水蒸气完全分解成氢气和氧气吸收483.6 kJ热量 | |
| D. | 常温下,2 mol H2与1 mol O2完全反应生成液态水放出的热量小于483.6 kJ |




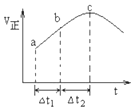 NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).
NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).