题目内容
6.已知:2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1,下列说法正确的是( )| A. | 在相同条件下,1 mol H2(g)与0.5 mol O2(g)的能量总和大于1 mol H2O(g)的能量 | |
| B. | 标准状况下,1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O放出的热量为241.8 kJ | |
| C. | 8 g水蒸气完全分解成氢气和氧气吸收483.6 kJ热量 | |
| D. | 常温下,2 mol H2与1 mol O2完全反应生成液态水放出的热量小于483.6 kJ |
分析 A.反应放热,说明反应物总能量高于生成物;
B.标准状况下生成液态水;
C.生成2mol水蒸气放热483.6kJ;
D.气态水转化为液态水会放热.
解答 解:A.反应放热,说明反应物总能量高于生成物,即在相同条件下,1 mol H2(g)与0.5 mol O2(g)的能量总和大于1 mol H2O(g)的能量,故A正确;
B.气态水转化为液态水会放热,标准状况下,1 mol H2(g)与0.5 mol O2(g)反应生成1 mol H2O放出的热量大于241.8 kJ,故B错误;
C.生成2mol水蒸气放热483.6kJ,则36 g水蒸气完全分解成氢气和氧气吸收483.6 kJ热量,故C错误;
D.气态水转化为液态水会放热,生成2mol气态水放热483.6 kJ,则常温下,2 mol H2与1 mol O2完全反应生成液态水放出的热量大于483.6 kJ,故D错误;
故选A.
点评 本题考查了热化学方程式的分析判断,化学反应能量变化和热化学方程式的表达意义是解题关键,题目较简单,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
9.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中 | 有红棕色气体产生,石灰水变浑浊 | 有NO2和CO2产生 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2 >I2 |
| D | 蔗糖中滴加浓硫酸并不断搅拌 | 产生黑色蓬松多孔固体 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
10.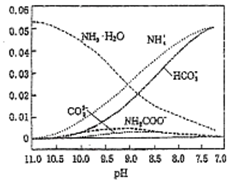 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )| A. | 由图中数据可计算NH4+的水解平衡常数约为1×10-9 | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断增大 | |
| D. | 由图可得离子的水解能力NH4+>HCO3- |
14.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | 煤的气化、液化、干馏均有化学变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | “地沟油”经过加工处理可用来制肥皂 |
11.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 自发反应的熵一定增大,非自发反应的焓一定减小 | |
| C. | 对于熵增反应,若一定温度下不能自发进行,则该反应的△H>0 | |
| D. | 对于△H>0的反应能自发进行,则该反应的△S<0 |
18.将19.2g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO和NO2混合气体5.6L(标况),则反应消耗的硝酸的物质的量是( )
| A. | 1.0 mol | B. | 0.9 mol | C. | 0.85mol | D. | 0.8 mol |
15.下列离子在溶液中能够大量共存的是( )
| A. | Fe3+,NH4+,NO3-,OH- | B. | NH4+,OH-,Cl-,Al3+ | ||
| C. | Fe2+,H+,NO3-,Cl- | D. | SO42-,OH-,Cl-,Na+ |
16.下列化学实验事实及其结论都正确的是( )
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | 二氧化硫能漂白有色布料 | 二氧化硫具有强氧化性 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |