题目内容
2.下列化学方程式的叙述正确的是( )| A. | 已知2C(s)+O2(g)=2CO(g)△H=-22lkJ/mol,则C的燃烧热为110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 含20.0gNaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
分析 A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
B.物质的能量越高越不稳定;
C.依据中和反应实质计算分析,氢氧根离子和氢离子反应是放热反应;
D.CO燃烧生成二氧化碳还会放出热量.
解答 解:A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;反应生成的是一氧化碳不是稳定氧化物,不符合燃烧热概念,故A错误;
B.由热化学方程式可知,石墨总能量小于金刚石,则石墨较稳定,故B错误;
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+HCl(aq)=NCl(aq)+H2O(l);△H=-57.3kJ/mol,故C正确;
D.CO燃烧生成二氧化碳还会放出热量,所以等物质的量的C燃烧生成CO放出热量比生成二氧化碳放出的热量少,△H为负值,所以△H1<△H2,故D错误;
故选C.
点评 本题考查反应热及焓变,题目难度中等,本题注意把握热化学方程式的意义,把握比较反应热的方法,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.胡萝卜中含有大量的β-胡萝卜素,被人体吸收后可转化成视黄醇(即维生素A),是目前最安全补充维生素A的产品.在体内酶的催化下,1mol β-胡萝卜素可氧化为2mol视黄醛,然后再转化为视黄醇,其过程如下:

已知: $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$ +
+
则下列说法错误的是( )

已知:
 $\stackrel{氧化}{→}$
$\stackrel{氧化}{→}$ +
+
则下列说法错误的是( )
| A. | β-胡萝卜素的化学式为C40H84 | |
| B. | β-胡萝卜素在人体吸收时可以用油脂作为相应的溶剂 | |
| C. | 反应I的类型为还原反应 | |
| D. | 许多保健品中都含有β-胡萝卜素,从其结构推测可能的作用是抗氧化剂 |
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 将 lmolCl2通入到水中,则n(HClO)+n(Cl-)+n(ClO-)=2NA | |
| B. | 常温常压下,17g甲基(-14CH3)中所含的中子数为9NA | |
| C. | 含NA个阴离子的Na2O2溶于水形成1L溶液,Na+浓度为1 mol•L-1 | |
| D. | 某温度时,1LpH=6.5的纯水中含有1.0×10-6.5NA个H+ |
10.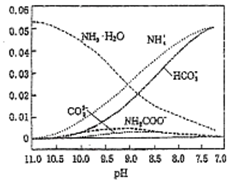 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )| A. | 由图中数据可计算NH4+的水解平衡常数约为1×10-9 | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断增大 | |
| D. | 由图可得离子的水解能力NH4+>HCO3- |
7.下列说法不正确的是( )
| A. | 化学反应过程中既有物质变化又有能量变化,能量的释放或吸收以物质变化为基础 | |
| B. | 研究化学反应进行的方向、快慢和限度是化学反应原理的重要内容 | |
| C. | Ag+和Cl-在水溶液中的反应瞬间发生,是因为这类反应活化能接近于零 | |
| D. | 能源就是能提供能量的资源,天然气、风能、水能都是可再生能源 |
14.化学与生产、生活密切相关.下列叙述不正确的是( )
| A. | 煤的气化、液化、干馏均有化学变化 | |
| B. | 海水淡化的方法有蒸馏法、电渗析法等 | |
| C. | 天然纤维和合成纤维的主要成分都是纤维素 | |
| D. | “地沟油”经过加工处理可用来制肥皂 |
11.下列说法正确的是( )
| A. | 凡是放热反应都是自发的,吸热反应都是非自发的 | |
| B. | 自发反应的熵一定增大,非自发反应的焓一定减小 | |
| C. | 对于熵增反应,若一定温度下不能自发进行,则该反应的△H>0 | |
| D. | 对于△H>0的反应能自发进行,则该反应的△S<0 |
12.下列说法正确的是( )
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为 285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(g)△H=-Q2kJ/mol,则 Q1>Q2 | |
| D. | 已知中和热为 57.3 kJ/mol,若将含 0.5molH2SO4的浓溶液与含 1molNaOH 的溶液混合,放出的热量等于 57.3kJ |
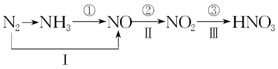 工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.