题目内容
7.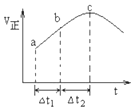 NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).
NO2与SO2混合可发生反应:NO2+SO2?SO3+NO.在100℃1molNO2与1molSO2的混合气体置于绝热(不与外界进行热交换)恒容密闭容器中发生上述反应,①正反应速率随时间变化的趋势如图所示,则下列说法正确的是C(填字母).A.反应在c点达到平衡状态
B.反应物浓度:a点小于b
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
②判断此反应达到平衡的标志是ADEF
A.体系的压强不再发生变化 B.混合气体的密度不变
C.混合气体的平均相对分子质量不变 D.各组分的物质的量浓度不再改变
E.体系的温度不再发生变化 F.v(NO2)正=v(NO)逆.
分析 ①A.反应在达到平衡状态时,反应速率应保持不变;
B.随着反应的进行,反应物浓度越来越小;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,根据平衡状态的特征:正逆反应速率相等,各组份的分数或浓度保持不变,及某些外部特征不变判断反应是否处于平衡状态;
解答 解:①A.反应在达到平衡状态时,反应速率应保持不变,故A错误;
B.随着反应的进行,反应物浓度越来越小,所以反应物浓度:a点大于b点,故B错误;
C.根据图可知,该反应在绝热条件下进行,反应速率受温度和浓度的因素影响,反应速率先增大后减小,说明该反应为放热反应,先由于温度升高反应速率增大,后浓度下降,反应速率下降,所以反应物的总能量高于生成物的总能量,故C正确;
D.根据图可知,ab段的速率小于bc段,所以△t1=△t2时,SO2的消耗量:a~b段小于b~c段,故D错误;
故选C;
②该反应为气体体积不变的放热反应,在绝热的条件下进行,则体系的温度是不断升高的,直至平衡状态,
A.根据上面的分析可知,反应过程中温度升高,体积不变,则体系压强增大,当体系的压强不再发生变化,则说明反应已经处于平衡状态,故A正确;
B.该反应体积不变,质量守恒,所以混合气体的密度不随反应的进行而改变,故不能作为平衡状态的判断标志,故B错误;
C.反应前后质量和物质的量都不变,所以混合气体的平均相对分子质量不能作为平衡状态的判断标志,故C错误;
D.各组分的物质的量浓度不再改变,则反应处于平衡状态,故D正确;
E.根据上面的分析可知,体系的温度不再发生变化,反应处于平衡状态,故E正确;
F.v(NO2)正=v(NO)逆,则反应处于平衡状态,故F正确;
故选ADEF.
点评 本题将能量变化、化学平衡等知识柔和在一起进行考查,充分体现了高考的综合性,看似综合性较强的问题,只要细细分析,还是能各个突破的.

 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )| A. | 由图中数据可计算NH4+的水解平衡常数约为1×10-9 | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断增大 | |
| D. | 由图可得离子的水解能力NH4+>HCO3- |
| A. | 1.0 mol | B. | 0.9 mol | C. | 0.85mol | D. | 0.8 mol |
| A. | Fe3+,NH4+,NO3-,OH- | B. | NH4+,OH-,Cl-,Al3+ | ||
| C. | Fe2+,H+,NO3-,Cl- | D. | SO42-,OH-,Cl-,Na+ |
| A. | .硅酸三钙 | B. | .碳酸二钙 | C. | 铝酸三钙 | D. | .碳酸钙 |
| A. | 等质量的硫蒸气和硫磺分别完全燃烧,二者放出的热量一样多 | |
| B. | 氢气的燃烧热为 285.8kJ/mol,则氢气燃烧的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ/mol | |
| C. | 2H2(g)+O2(g)=2H2O(l)△H=-Q1kJ/mol 2H2(g)+O2(g)=2H2O(g)△H=-Q2kJ/mol,则 Q1>Q2 | |
| D. | 已知中和热为 57.3 kJ/mol,若将含 0.5molH2SO4的浓溶液与含 1molNaOH 的溶液混合,放出的热量等于 57.3kJ |
| A. | 1,2-二溴乙烷和1,1-二氯丙烷 | B. | 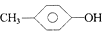 和 和 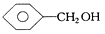 | ||
| C. | 苯 和 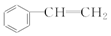 | D. | 丙炔 和 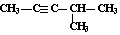 |
| 选项 | 实验事实 | 结论 |
| A | 二氧化硅可以和NaOH溶液及HF溶液反应 | 二氧化硅属于两性氧化物 |
| B | 二氧化硫能漂白有色布料 | 二氧化硫具有强氧化性 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝的熔点高 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 短时间存放FeCl2溶液时,可添加少量铁粉防止Fe2+被氧化 | |
| B. | Na2CO3溶液存放在带玻璃塞的玻璃试剂瓶中 | |
| C. | 氢氟酸存放在玻璃试剂瓶中 | |
| D. | 钠单质存放在四氯化碳中 |