题目内容
20.下列叙述Ⅰ和Ⅱ均正确并且有因果关系的是( )| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Fe3+有氧化性 | 用KSCN溶液可以鉴别Fe3+ |
| B | 浓硫酸有腐蚀性 | 常温下浓硫酸不能用铁罐盛装 |
| C | Cl2是非金属单质 | Cl2能使湿润的有色布条褪色 |
| D | 熔融状态的Al2O3中有自由移动的Al3+和O2- | 电解熔融状态的Al2O3制备Al |
| A. | A | B. | B | C. | C | D. | D |
分析 A.KSCN与三价铁离子发生络合反应生成血红色络合物;
B.常温下浓硫酸与铁发生钝化,阻止了反应的继续进行;
C.具有漂白性的不是氯气,次氯酸与水反应生成的次氯酸具有漂白性;
D.氧化铝为离子化合物,在熔融状态下能够电离出铝离子和氧离子.
解答 解:A.KSCN与三价铁离子发生络合反应生成血红色络合物,该反应中没有元素化合价变化,不是氧化还原反应,故A错误;
B.在常温下Fe与浓硫酸发生钝化,所以在常温下浓硫酸能用铁罐盛装,故B错误;
C.Cl2能使湿润的有色布条褪色,原因是氯气与水反应生成的次氯酸具有漂白性,而氯气不具有漂白性,故C错误;
D.Al2O3为离子化合物,熔融状态的Al2O3中有自由移动的Al3+和O2-,则电解熔融状态的Al2O3制备Al,故D正确;
故选D.
点评 本题考查化学实验方案的评价,题目难度中等,明确常见离子的性质及检验方法为解答关键,试题有利于提高学生的分析能力及灵活应用能力.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
10.由反应物 X 分别转化为 Y 和 Z 的能量变化如图所示.下列说法正确的是( )
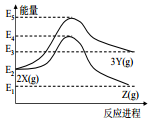

| A. | 由 X→Z 反应的△H<0 | B. | 由 X→Y 反应的△H=E5-E2 | ||
| C. | 增大压强有利于提高 Y 的产率 | D. | 升高温度有利于提高 Z 的产率 |
11.氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO合成.下列叙述正确的是( )
| A. | 上述反应中,N2是还原剂,Al2O3是氧化剂 | |
| B. | 上述反应中,每生成2 mol AlN需转移6 mol电子 | |
| C. | AlN中氮元素的化合价为+3 | |
| D. | AlN的摩尔质量为41 g |
8.下列物质分别在氯气中燃烧,能产生白烟现象的是( )
| A. | Na | B. | H2 | C. | Fe | D. | Cu |
12.设NA为阿伏伽德罗常数的值,下列有关说法正确的是( )
| A. | 在1L 0.1mol/L的Na2CO3溶液中,阴离子总数小于0.1NA | |
| B. | 常温常压下,17 g甲基(-14CH3)所含的电子数为9NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | 将1mol Cl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA |
9.下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 炭粉中加入浓硝酸并加热,导出的气体通入少量澄清石灰水中 | 有红棕色气体产生,石灰水变浑浊 | 有NO2和CO2产生 |
| B | 加热盛有NH4Cl固体的试管 | 试管底部固体消失,试管口有晶体凝结 | NH4Cl固体可以升华 |
| C | 向含I-的无色溶液中滴加少量新制氯水,再滴加淀粉溶液 | 加入淀粉后溶液变成蓝色 | 氧化性:Cl2 >I2 |
| D | 蔗糖中滴加浓硫酸并不断搅拌 | 产生黑色蓬松多孔固体 | 浓硫酸具有吸水性和强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
10.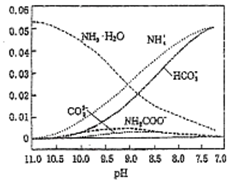 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
 40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )
40℃,在氨-水体系中不断通入CO2,各种离子物质的量浓度随pH的变化趋势如图所示.下列说法正确的是( )| A. | 由图中数据可计算NH4+的水解平衡常数约为1×10-9 | |
| B. | 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-) | |
| C. | 随着CO2的通入,$\frac{[O{H}^{-}]}{[N{H}_{3}•{H}_{2}O]}$不断增大 | |
| D. | 由图可得离子的水解能力NH4+>HCO3- |
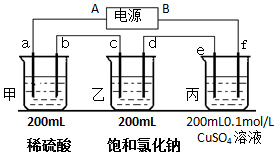 用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则
用上面的电池对下物质进行电解,其中a、b、c、d、e、f电极均为惰性电极,通电后,a极产生的气体明显多于b极,2分钟后,测得乙池的pH为12,则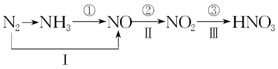 工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.
工业上硝酸的制备和自然界中硝酸的生成既有相同的地方,又有区别.线路①、②、③是工业生产硝酸的主要途径,线路Ⅰ、Ⅱ、Ⅲ是雷电高能固氮过程中硝酸的生成途径.