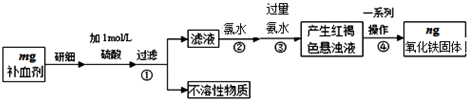
题目内容
6.已知A和B两只试管的溶液中含有K+、Ag+、Mg2+、Cl-、NO3-、OH-六种离子,向A试管中滴加酚酞溶液呈红色.请回答下列问题:(1)A试管的溶液中含有上述离子有K+、OH-、Cl-;检验其中的阳离子可用的实验方法是焰色反应实验,
实验的现象是透过蓝色钴玻璃有紫色火焰若向A溶液中加入铝片写出该化学反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)向某试管中滴加稀盐酸产生白色沉淀,则该试管为B(填A或B);
(3)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则反应的离子方程式分别为HCO3-+H+=H2O+CO2↑、Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O.
分析 试管A的溶液中滴入酚酞试液呈粉红色,说明溶液显碱性,一定含有OH-,根据离子共存原理,一定没有Ag+、Mg2+,一定含有K+.试管B中一定含有Ag+、Mg2+,则一定没有Cl-,一定含有NO3-;
(1)根据以上分析判断试管A的溶液中存在的离子;检验钾离子用焰色反应实验;铝和碱液生成偏铝酸盐和氢气;
(2)根据试管A和B中含有的离子进行分析;
(3)分别滴加盐酸和少量Ba(OH)2,氢离子和碳酸氢根离子生成水和二氧化碳,碳酸氢根离子与氢氧化钡溶液反应生成碳酸钡沉淀和碳酸根离子,据此书写离子方程式.
解答 解:向试管A的溶液中滴入酚酞试液呈粉红色,说明溶液显碱性,一定含有OH-,根据离子共存原理,一定没有Ag+、Mg2+,一定含有K+.试管B中一定含有Ag+、Mg2+,则一定没有Cl-,一定含有NO3-;
综上所述,(1)试管A中含有K+、OH-、Cl-,试管B中含有Ag+、Mg2+、NO3-;钾离子的检验用焰色反应实验,透过蓝色钴玻璃有紫色火焰,则说明有钾离子;若向A溶液中加入铝片,铝和碱液生成偏铝酸盐和氢气,反应为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:K+、OH-、Cl-;焰色反应;透过蓝色钴玻璃有紫色火焰;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管中含有Ag+,为试管B,
故答案为:B;
(3)若向试管A的溶液中的阳离子组成的碳酸氢盐溶液中,分别滴加盐酸和少量Ba(OH)2,则发生反应的离子方程式为:HCO3-+H+=H2O+CO2↑,Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O,
故答案为:HCO3-+H+=H2O+CO2↑;Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O.
点评 本题考查了离子共存及离子方程式的书写,题目难度中等,试题涉及的内容较多,充分考查了学生对所学知识的掌握情况;注意掌握离子反应发生的条件及离子方程式的书写方法.

| A. | 蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体 | |
| B. | 聚乙烯、聚氯乙烯,纤维素都属于合成高分子 | |
| C. | 分馏、干馏,裂化都是化学变化 | |
| D. | 石蜡油分解产物可使溴水和酸性高锰酸钾溶液褪色 |
| A. | 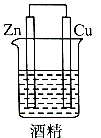 | B. | 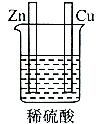 | C. | 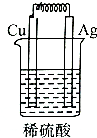 | D. |  |
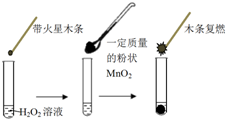 研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:(1)甲同学欲用图所示实验来证明MnO2是H2O2分解反应的催化剂.该实验不能(填“能”或“不能”)达到目的,原因是因为没有确认MnO2的质量和性质是否改变.
(2)为探究MnO2的量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,
在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如下:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如下实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)①查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个
氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl=2FeCl3+2H2O(按反应发生的顺序写).
②在上述实验过程中,分别检测出溶液中有二价锰、二价铁和一价铜,由此得出选择作为H2O2分解反应的催化剂需要满足的条件是H2O2分解反应的催化剂具有氧化性,且其氧化性强于H2O2;催化剂被还原后所得物质又能被H2O2氧化生成催化剂.
| AgCl | Ag2CrO4 | Ag2S | AgBr | AgI | |
| 颜色 | 白色 | 橘红色 | 黑色 | 淡黄色 | 黄色 |
| Ksp | 1.8×10-10 | 1.1×10-12 | 6.0×10-50 | 7.7×10-13 | 8.5×10-16 |
| A. | 往Ag2S悬浊液中加入少量K2CrO4溶液,沉淀将由黑色变成橘红色 | |
| B. | 反应2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数K=5.4×1029 | |
| C. | 用AgNO3标准溶液测定溶液中的c(Cl-),可用K2CrO4或K2S溶液作指示剂 | |
| D. | 在20mL浓度均为1.8×10-6mol•L-1的Cl-、Br-及I-的混合溶液中,逐滴(1滴约0.05mL)加入0.01mol•L-1的AgNO3溶液,可依次得到AgCl、AgBr和AgI沉淀 |
| A. | HCl | B. | NH3 | C. | CH4 | D. | CO2 |