题目内容
 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.①CH4(g)+H2O(g)?CO(g)+3H2(g)?H
②CO(g)+2H2(g)?CH3OH(g)?H
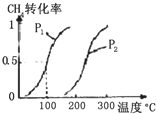
将0.20mol CH4和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图:
(1)温度不变,缩小体积,①的逆反应速率
(2)反应①的?H
(3)在压强为0.1Mpa条件下,将amolCO与3amolH2的混合气体在催化剂作用下进行反应②再生成甲醇.为了发寻找合成甲醇的适宜的温度和压强,某同学设计了二组实验,部分实验条件已经填在下面实验设计表中.请在空格中填入剩余的实验条件数据.
| 实验编号 | T(°C) | n(CO)/n(H2) | p(MPa) | ||
| I | 150 |
|
0.1 | ||
| II | 5 | ||||
| III | 350 | 5 |
| 1 |
| 2 |
A.c(H2)减少B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加D.重新平衡时c(H2)/c(CH2OH)减小
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)?H1=-1275.6kJ?mol-1
②2CO(g)+O2(g)=2CO2(g)?H2=-556.0kJ?mol-1
③H2O(g)=H2O(l)?H3=-44.0kJ?mol-1
写出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式
考点:转化率随温度、压强的变化曲线,用盖斯定律进行有关反应热的计算,化学平衡常数的含义,化学反应速率的影响因素,化学平衡的影响因素
专题:化学反应中的能量变化,化学平衡专题
分析:(1)根据容器容积缩小,增大了容器的压强分析反应速率变化;
(2)根据图象中温度变化对甲烷转化率的影响判断该反应吸热还是放热反应;100°C时的甲烷的转化率计算出平衡时各组分的浓度,再根据平衡常数表达式K=
计算出平衡常数;
(3)实验目的为探究合成甲醇的适宜的温度和压强,根据“控制变量法”探究外界条件对化学平衡的影响完成表格中空格数据;根据容器容积缩小,增大了容器的压强分析平衡CO(g)+2H2(g)?CH3OH(g)的移动情况;
(4)根据盖斯定律计算出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式.
(2)根据图象中温度变化对甲烷转化率的影响判断该反应吸热还是放热反应;100°C时的甲烷的转化率计算出平衡时各组分的浓度,再根据平衡常数表达式K=
| c(CO)×c3(H2) |
| c(CH4)×c(H2O) |
(3)实验目的为探究合成甲醇的适宜的温度和压强,根据“控制变量法”探究外界条件对化学平衡的影响完成表格中空格数据;根据容器容积缩小,增大了容器的压强分析平衡CO(g)+2H2(g)?CH3OH(g)的移动情况;
(4)根据盖斯定律计算出甲醇不完全燃烧生成一氧化碳的液态水的热化学方程式.
解答:
解:(1)缩小容器的容积,导致压强增大,正逆反应速率均加快,
故答案为:增大;
(2)由题中图象知温度升高,CH4的转化率变大,说明该反应的正反应为吸热反应,
在100℃时,CH4的转化率为0.5,则有:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始:0.2mol 0.3mol 0 0
变化:0.1mol 0.1mol 0.1mol 0.3mol
平衡:0.1mol 0.2mol.1mol 0.3mol
K=
=
=1.35×10-3,
故答案为:>;1.35×10-3;
(3)显然该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,故实验II的温度是150℃,n(CO)/n(H2)=
,同样实验III中n(CO)/n(H2)同样等于
,
由于反应CO(g)+2H2(g)?CH3OH(g)是气体体积减小的反应,现体积缩小,即增大压强,反应物和生成物的浓度均增大,正逆反应速率均加快,化学平衡向正反应方向移动,综上分析,选项C和D正确,
故答案为:实验II:150;
; 实验III:
; CD;
(4)根据盖斯定律得(①-②+③×4)÷2得:CH3OH(l)+O2(g)
CO(g)+2H2O(g) △H=-447.8 kJ?mol-1,
故答案为:CH3OH(l)+O2(g)
CO(g)+2H2O(g) H=-447.8 kJ?mol-1.
故答案为:增大;
(2)由题中图象知温度升高,CH4的转化率变大,说明该反应的正反应为吸热反应,
在100℃时,CH4的转化率为0.5,则有:
CH4(g)+H2O(g)?CO(g)+3H2(g)
起始:0.2mol 0.3mol 0 0
变化:0.1mol 0.1mol 0.1mol 0.3mol
平衡:0.1mol 0.2mol.1mol 0.3mol
K=
| c(CO)×c3(H2) |
| c(CH4)×c(H2O) |
(
| ||||
(
|
故答案为:>;1.35×10-3;
(3)显然该同学通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,故实验II的温度是150℃,n(CO)/n(H2)=
| 1 |
| 3 |
| 1 |
| 3 |
由于反应CO(g)+2H2(g)?CH3OH(g)是气体体积减小的反应,现体积缩小,即增大压强,反应物和生成物的浓度均增大,正逆反应速率均加快,化学平衡向正反应方向移动,综上分析,选项C和D正确,
故答案为:实验II:150;
| 1 |
| 3 |
| 1 |
| 3 |
(4)根据盖斯定律得(①-②+③×4)÷2得:CH3OH(l)+O2(g)
| 点燃 |
故答案为:CH3OH(l)+O2(g)
| ||
点评:本题考查化学平衡图象、反应速率计算、化学平衡常数的有关计算、化学平衡的影响因素等,难度中等,(3)中注意通过“控制变量法”探究外界条件对化学平衡的影响.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B、向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
下列装置和操作能达到实验目的是( )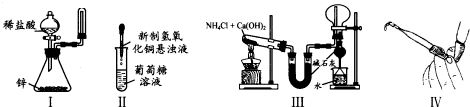

| A、实验I:制取并收集氢气 |
| B、实验II:验证葡萄糖的还原性 |
| C、实验III:实验室制氨气并收集干燥的氨气 |
| D、实验Ⅳ:检查碱式滴定管是否漏液 |
设阿伏加德罗常数的数值为nA,下列说法正确的是( )
| A、1molNa2O2和水完全反应,转移电子数为2nA |
| B、0.5L0.2mol?L-1FeCl3溶液中,含Fe3+离子数为0.1nA |
| C、理论上氢氧燃料电池负极消耗11.2L标准状况下气体,外线路通过电子数为nA |
| D、常温常压下,28g乙烯和丙烯混合气体含有的碳原子总数为2.5nA |
下列离子方程式书写不正确的是( )
A、氢氧化钡溶液与稀硫酸:Ba2++2OH-+2H++SO
| ||
B、Al2(SO4)3浴液中加入足量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH
| ||
| C、FeBr2溶液中通入过量Cl2 2Fe2++6Br-+4Cl2=2Fe3++3Br2+8Cl- | ||
| D、Fe2O3溶于过量的盐酸中:Fe2O3+6H+=2Fe3++3H2O |
设NA为阿伏加德罗常数,以下叙述正确的是( )
| A、23 g钠在氧气中完全燃烧失去电子数为NA |
| B、标准状况下,22.4L已烷所含碳原子数为6NA |
| C、20℃、1.01×105Pa时,1.6gC2H4和1.2g CO的混合气体,含气体分子数为0.1NA |
| D、0.1L 3mol?L-1的Al2(SO4)3溶液中含有的Al3+数目为0.6NA |
 CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物.工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.