题目内容
等物质的量的NaHCO3和KHCO3的混合物4.60g,与1.00mol/L的盐酸反应:
(1)试分析,欲求标准状况下生成的CO2气体的体积时,还需要什么数据 (用a表示,并注明单位)
(2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
(3)若NaHCO3和KHCO3的物质的量不相等,则4.60g的混合物与足量盐酸完全反应时,在标准状况下生成的CO2气体的体积大于 L,小于 L.
(1)试分析,欲求标准状况下生成的CO2气体的体积时,还需要什么数据
(2)利用所确定的数据,求标准状况下CO2气体的体积(填写下表):
| 所需数据取值范围 | 生成CO2气体的体积 | |
| 盐酸不足量时 | ||
| 盐酸足量时 |
考点:化学方程式的有关计算
专题:计算题
分析:(1)发生反应HCO3-+H+=CO2↑+H2O,固体不一定完全反应,欲计算生成的CO2的量,必须要知道盐酸的体积a L;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:(84 g/mol+100 g/mol)×ymol=4.60 g,解得y=0.025mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.0500 mol,V(HCl)=0.0500 L,①当盐酸不足量,即a<0.0500 L时,按HCl量计算V(CO2);
②当盐酸足量,即a≥0.0500 L时,按HCO3-的量计算V(CO2);
(3)若KHCO3为4.60 g时,生成生成CO2气体的体积最小,若NaHCO3为4.60 g时,生成CO2气体的体积最大,据此计算.
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:(84 g/mol+100 g/mol)×ymol=4.60 g,解得y=0.025mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.0500 mol,V(HCl)=0.0500 L,①当盐酸不足量,即a<0.0500 L时,按HCl量计算V(CO2);
②当盐酸足量,即a≥0.0500 L时,按HCO3-的量计算V(CO2);
(3)若KHCO3为4.60 g时,生成生成CO2气体的体积最小,若NaHCO3为4.60 g时,生成CO2气体的体积最大,据此计算.
解答:
解:(1)发生反应HCO3-+H+=CO2↑+H2O,固体不一定完全反应,欲计算生成的CO2的量,必须要知道盐酸的体积a L,
故答案为:盐酸的体积a L;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:
(84 g/mol+100 g/mol)×ymol=4.60 g,解得y=0.025mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.0500 mol,V(HCl)=0.0500 L,
①当盐酸不足量,即a<0.0500 L时,按HCl量计算,V(CO2)=22.4 L/mol×n(HCl)=22.4 L/mol×aL×1.00mol/L=22.4a L;
②当盐酸足量,即a≥0.0500 L时,按HCO3-的量计算,V(CO2)=22.4 L/mol×0.0500mol×2=1.12 L;
故答案为:盐酸不足量时:a<0.0500L,22.4a L;盐酸足量时:a≥0.0500L,1.12 L;
(3)若KHCO3为4.60 g时,生成生成CO2气体的体积最小,由反应HCO3-+H+=CO2↑+H2O可知:V(CO2)=
×22.4 L/mol=1.03L,
若NaHCO3为4.60 g时,生成CO2气体的体积最大,由反应HCO3-+H+=CO2↑+H2O可知:V(CO2)=
×22.4 L/mol=1.23L,
故答案为:1.03;1.23.
故答案为:盐酸的体积a L;
(2)设NaHCO3、KHCO3的物质的量均为ymol,则:
(84 g/mol+100 g/mol)×ymol=4.60 g,解得y=0.025mol,当恰好完全反应时,由反应HCO3-+H+=CO2↑+H2O可知,消耗n(HCl)=0.0500 mol,V(HCl)=0.0500 L,
①当盐酸不足量,即a<0.0500 L时,按HCl量计算,V(CO2)=22.4 L/mol×n(HCl)=22.4 L/mol×aL×1.00mol/L=22.4a L;
②当盐酸足量,即a≥0.0500 L时,按HCO3-的量计算,V(CO2)=22.4 L/mol×0.0500mol×2=1.12 L;
故答案为:盐酸不足量时:a<0.0500L,22.4a L;盐酸足量时:a≥0.0500L,1.12 L;
(3)若KHCO3为4.60 g时,生成生成CO2气体的体积最小,由反应HCO3-+H+=CO2↑+H2O可知:V(CO2)=
| 4.60g |
| 100g/mol |
若NaHCO3为4.60 g时,生成CO2气体的体积最大,由反应HCO3-+H+=CO2↑+H2O可知:V(CO2)=
| 4.60g |
| 84g/mol |
故答案为:1.03;1.23.
点评:本题考查混合物的有关计算,属于讨论型计算,确定区间是讨论计算的关键,侧重对学生思维能力的考查,难度中等.

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目
阿佛加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
| A、60gSiO2晶体中含有2×6.02×1023个Si-O键 |
| B、18gD2O(重水)完全电解,转移2×6.02×1023个电子 |
C、720gC60晶体(如图)中含有6.02×1023个晶胞结构单元 |
| D、14g两种烯烃CnH2n和CmH2m混合物,含有共用电子对数目为3×6.02×1023 |
下列离子方程式正确的是( )
| A、Mg(HCO3)2溶液与澄清石灰水混合:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、FeCl3溶液中通入足量H2S气体:2Fe3++3S2-=2FeS↓+S↓ |
| C、AlCl3溶液中加入过量的氨水溶液:Al3++4OH-=AlO2-+2H2O |
| D、等物质的量的Ba(OH)2和 NH4HCO3在大量的水中混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |
用NA表示阿伏加德罗常数,下列说法正确的是( )
| A、18g D2O含有电子数为10 NA | ||
| B、标准状况下,11.2L乙酸中含有的分子数目为0.5 NA | ||
| C、6.2g氧化钠中含有的离子数为0.3NA | ||
D、200 mL 1 mol?L-1Fe2(SO4)3溶液中,Fe3+和SO
|
 如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是( )
如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g)?2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法错误的是( )| A、反应开始时,B容器中化学反应速率快 |
| B、A容器中X的转化率为40%,且比B容器中X的转化率大 |
| C、打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计) |
| D、打开K达新平衡后,升高B容器温度,A容器体积一定增大 |
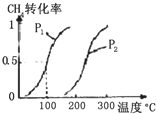 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.