题目内容
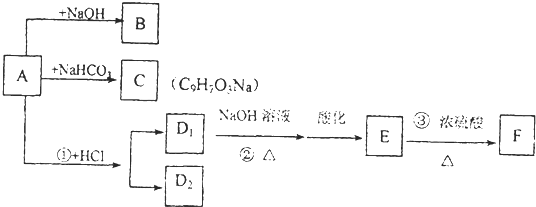
下图字母所表示的物质均为中学化学中的常见物质,其中D、E为非金属气体单质,D原子电子层数和最外层电子数均比E的原子少1,J为一种金属单质,其余为化合物,A、B的焰色均为黄色,它们存在如下转化关系,部分反应中需要的水或生成的水及次要产物均已略去.

回答下列问题:
(1)D的元素在周期表中的位置是 ;E的原子结构简图为: ;A的电子式为: .I的化学式为: .
(2)写出指定反应的离子方程式:①: ; ⑧ .
(3)反应②在电解槽中进行,反应后溶液的pH增大的电极是: ,原因是: .
(4)反应③的实验现象是: ;反应④和⑨比较,相同的实验现象有: .

回答下列问题:
(1)D的元素在周期表中的位置是
(2)写出指定反应的离子方程式:①:
(3)反应②在电解槽中进行,反应后溶液的pH增大的电极是:
(4)反应③的实验现象是:
考点:无机物的推断
专题:推断题
分析:D、E为非金属气体单质,D原子电子层数和最外层电子数均比E的原子少1,由周期表可知D为O2,E为Cl2,A、B的焰色均为黄色,由转化关系可知A为Na2O2,B为NaCl,C为H2O,J为一种金属单质,由转化关系可知应为变价金属,应为Fe,则G为FeCl3,F为Fe3O4,H为FeCl2,I为Fe(OH)3,结合对应的物质的性质以及题目要求解答该题.
解答:
解:D、E为非金属气体单质,D原子电子层数和最外层电子数均比E的原子少1,由周期表可知D为O2,E为Cl2,A、B的焰色均为黄色,由转化关系可知A为Na2O2,B为NaCl,C为H2O,J为一种金属单质,由转化关系可知应为变价金属,应为Fe,则G为FeCl3,F为Fe3O4,H为FeCl2,I为Fe(OH)3,
(1)D为O2,O元素位于周期表第二周期ⅥA族,E为Cl2,原子结构示意图为 ,A为Na2O2,电子式为
,A为Na2O2,电子式为 ,I为Fe(OH)3,
,I为Fe(OH)3,
故答案为:第二周期ⅥA族; ;
; ;Fe(OH)3;
;Fe(OH)3;
(2)反应①为过氧化钠与盐酸的反应,反应的离子方程式为2Na2O2+4H+=4Na++O2↑+2H2O;
反应⑧为四氧化三铁与盐酸的反应,反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:2Na2O2+4H+=4Na++O2↑+2H2O;Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)电极饱和食盐水,阴极生成氢气,H+放电促进水电离OH-浓度增大,生成氢氧化钠,阳极生成氯气,故答案为:阴极;阴极H+放电促进水电离OH-浓度增大;
(4)氯气与铁反应,生成氯化铁,产生棕黄色的烟,反应④和⑨中,过氧化钠与水反应生成氧气,可观察到无色气体生成,同时生成氢氧化铁红褐色沉淀,
故答案为:产生棕黄色的烟;均有无色气体和红褐色沉淀产生.
(1)D为O2,O元素位于周期表第二周期ⅥA族,E为Cl2,原子结构示意图为
 ,A为Na2O2,电子式为
,A为Na2O2,电子式为 ,I为Fe(OH)3,
,I为Fe(OH)3,故答案为:第二周期ⅥA族;
 ;
; ;Fe(OH)3;
;Fe(OH)3;(2)反应①为过氧化钠与盐酸的反应,反应的离子方程式为2Na2O2+4H+=4Na++O2↑+2H2O;
反应⑧为四氧化三铁与盐酸的反应,反应的离子方程式为Fe3O4+8H+=Fe2++2Fe3++4H2O,
故答案为:2Na2O2+4H+=4Na++O2↑+2H2O;Fe3O4+8H+=Fe2++2Fe3++4H2O;
(3)电极饱和食盐水,阴极生成氢气,H+放电促进水电离OH-浓度增大,生成氢氧化钠,阳极生成氯气,故答案为:阴极;阴极H+放电促进水电离OH-浓度增大;
(4)氯气与铁反应,生成氯化铁,产生棕黄色的烟,反应④和⑨中,过氧化钠与水反应生成氧气,可观察到无色气体生成,同时生成氢氧化铁红褐色沉淀,
故答案为:产生棕黄色的烟;均有无色气体和红褐色沉淀产生.
点评:本题考查无机物的推断,侧重于学生的分析能力和元素化合物知识的综合应用的考查,为高考常见题型和高频考点,注意把握物质的颜色等性质,明确物质的种类为解答该题的关键,难度中等.

练习册系列答案
相关题目
下列离子方程式中书写正确的是( )
| A、过氧化钠固体与水反应:2O2-+2H2O=4OH-+O2↑ | ||
B、在H2O2中加入酸性KMnO4溶液:2M
| ||
| C、醋酸溶液与大理石反应:CaCO3+2H+=Ca2++H2O+CO2↑ | ||
| D、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO |
下列各组离子可以大量共存,加入括号中试剂,整体可能形成无色澄清溶液的是( )
| A、Na+、NH4+、Fe2+、NO3-(稀硫酸) |
| B、Al3+、K+、HCO3-、NO3-(NaOH溶液) |
| C、NH4+、Ag+、K+、NO3-(NaOH溶液) |
| D、Na+、K+、AlO2-、SiO32-(稀硝酸) |
下列离子方程式正确的是( )
| A、Mg(HCO3)2溶液与澄清石灰水混合:Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、FeCl3溶液中通入足量H2S气体:2Fe3++3S2-=2FeS↓+S↓ |
| C、AlCl3溶液中加入过量的氨水溶液:Al3++4OH-=AlO2-+2H2O |
| D、等物质的量的Ba(OH)2和 NH4HCO3在大量的水中混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3?H2O+H2O |

 甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
甲醇被称为21世纪的新型燃料,工业上用CH4和H2O为原料通过下列反应①和②,来制备甲醇.
