题目内容
7.下列反应中浓硫酸只表现强氧化性的是( )| A. | 2NH3+H2SO4(浓)═(NH4)2SO4 | |
| B. | C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
分析 硫酸只表现强氧化性,说明该反应过程硫酸中S元素只得电子发生还原反应,据此分析解答.
解答 解:A.反应中硫酸中硫元素化合价不变,体现硫酸的酸性,故A不选;
B.反应中硫元素化合价全部降低,浓硫酸只表现强的氧化性,故B选;
C.反应中硫酸中部分硫化合价降低,部分不变,体现硫酸的强氧化性和酸性,故C不选;
D.反应中硫酸中部分硫化合价降低,部分不变,体现硫酸的强氧化性和酸性,故D不选;
故选:B.
点评 本题考查了硫酸的性质,硫酸具有吸水性、脱水性及强氧化性,明确元素化合价变化即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列关于有机物的说法正确的是( )
| A. | 异戊烷和2-甲基丁烷互为同系物 | |
| B. | 丙烯分子中所有原子均在同一平面上 | |
| C. | 苯能发生氧化反应、还原反应和取代反应 | |
| D. | 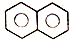 和C4H10的二氯代物数目相同 和C4H10的二氯代物数目相同 |
19.在密闭容器中,反应2SO2(g)+O2(g)=2SO3(g) 达到平衡后,若将容器体积缩小一半,对反应产生的影响是( )
| A. | V(正)减小,V(逆)增大 | B. | V(正)增大,V(逆)减小 | C. | V(正)、V(逆)都减小 | D. | V(正)、V(逆)都增大 |
15.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 常温下,1mol氩气含有的原子数一定为NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液完全反应,转移电子总数为0.1NA | |
| C. | 56g铁片与足量浓硫酸共热反应生成NA个SO2分子 | |
| D. | 常温下,1L pH=12的Na2CO3溶液中含有CO32-的数目大于0.01NA |
2.锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1:
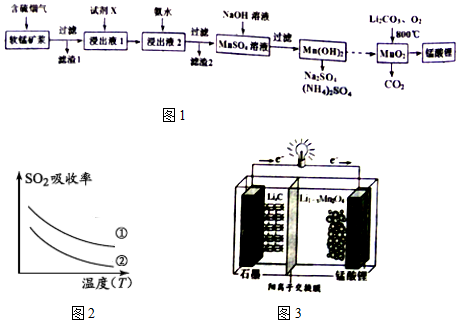
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
(1)已知:(图2)表二
表二
下列措施可提高SO2吸收率的是ad(填序号)
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.

已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.
12.双酚A作为食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害很大.下列有关双酚A的叙述不正确的是( )


| A. | 双酚A的分子式是C15H16O2 | |
| B. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| C. | 反应①中,1 mol双酚A最多消耗6 mol Br2 | |
| D. | 反应②的产物中只有一种官能团 |
19.一种新型材料B4C,它可用于制作切削工具和高温热交换器.关于B4C的晶体类型推断正确的是( )
| A. | 分子晶体 | B. | 离子晶体 | C. | 原子晶体 | D. | 不能确定 |
16.亚油酸通常为淡黄色透明液体,能降低血脂,降低血清中胆固醇含量,防止动脉粥样硬化,主要来源于豆油、花生油、棉籽油和亚麻仁油,其结构简式为CH3(CH2)3(CH2CH=CH)2(CH2)7COOH.下列说法中正确的是( )
| A. | 亚油酸是一种植物油,常温下呈液态 | |
| B. | 1mol亚油酸可以与3molH2反应 | |
| C. | 亚油酸能使溴的四氯化碳溶液褪色 | |
| D. | 亚油酸可与NaOH溶液发生皂化反应 |
17.NA为阿伏加德罗常数的值.下列说法正确是( )
| A. | 44g CO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L 0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 0.5mol CH5+中含有的电子数目为5NA | |
| D. | 常温下,1L 0.5 mol/L Ba(OH)2溶液中水电离的OH-个数为0.1NA |