题目内容
2.锰酸锂(LiMn2O4)可作为锂离子电池的正极材料.工业上利用软锰矿浆吸收含硫烟气(SO2 和O2)制备锰酸锂,生产流程如图1:
已知:①软锰矿主要成分为MnO2,含少量Fe2O3、FeO、Al2O3、SiO2等杂质.
②软锰矿浆在吸收含硫烟气的过程中酸性逐渐增强.
③部分氢氧化物沉淀相关的溶液pH如表一:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 3.4 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 4.7 | 9.8 |
表二
| 实验序号 | SO2浓度(g•m-3) | 烟气流速(mL•min-1) |
| ① | 4.1 | 55 |
| ② | 4.1 | 96 |
a.降低通入含硫烟气的温度 b.升高通入含硫烟气的温度
c.减少软锰矿浆的进入量 d.减小通入含硫烟气的流速
(2)加入试剂X能提高产品纯度,则X可以是H2O2(填化学式)
(3)加氨水调溶液pH在5~6之间,目的是除去铁、铝元素.
(4)锰酸锂可充电电池(图3)的总反应式为:Li1-xMnO4+LixC$?_{放电}^{充电}$ LiMnO4+C(x<1)
①放电时,电池的正极反应式为Li1-xMnO4+xLi++xe-=LiMn2O4
②充电时,若转移1mole-,则石墨电极将增重7g.
分析 高温焙烧含硫废渣产生的SO2废气,软锰矿浆的主要成分是MnO2,通入SO2浸出液的pH<2,其中的金属离子主要是Mn2+,则MnO2与SO2发生氧化还原反应,浸出液还含有少量的Fe2+、Al3+等其他金属离子,Fe2+具有还原性,可以被MnO2在酸性条件下氧化成Fe3+,在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+等阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.从吸附率的图可以看出,SO2的吸收效率随温度的升高而降低,当温度和浓度相同时,SO2的吸收效率随烟气流速的增大而降低.调节pH值在5~6间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀,过滤,滤渣主要有氢氧化铁、氢氧化铝.由于制取的MnSO4•H2O含有结晶水,故操作a采用蒸发浓缩结晶的方法,得到MnSO4•H2O,
(1)由图2知,SO2的吸收效率随温度的升高而降低,当温度和浓度相同时,SO2的吸收效率随烟气流速的增大而降低;
(2)由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.将亚铁离子氧化成铁离子,故应选择绿色氧化剂;
(3)在氧化后的液体中加入石灰浆,杂质中含有Fe2+、Al3+等阳离子,由沉淀的pH范围知,Fe2+的沉淀与Mn2+离子的沉淀所需的pH接近,而Fe3+则相差很远,故可以将Fe2+氧化成Fe3+而除杂.加氨水调节pH值在5~6间,Fe3+、Al3+阳离子通过调pH值,转化为氢氧化铁、氢氧化铝沉淀.
(4)①放电时的反应为Li1-xMnO4+LixC=LiMnO4+C,化合物中Li元素的化合价降低,单质Li中元素的化合价升高,结合原电池中负极发生氧化反应,正极发生还原反应;
②充电时,若转移1mole-,则石墨电极上产生1molLi;
解答 解:(1)a.降低通入含硫烟气的温度,可提高SO2吸收率.a正确;
b.升高通入含硫烟气的温度,不能提高SO2吸收率.b错误;
c.减少软锰矿浆的进入量,不能提高SO2吸收率.c错误;
d.减小通入含硫烟气的流速,可提高SO2吸收率.d正确.
故答案为:ad;
(2)将亚铁离子氧化成铁离子,应选择H2O2,
故答案为:H2O2;
(3)加氨水调溶液pH在5~6之间,使Fe3+、Al3+阳离子转化为氢氧化铁、氢氧化铝沉淀而除去,
故答案为:除去铁、铝元素;
(4)①根据总反应式可知Li失去电子,电池负极反应式为:xLi-xe-═xLi+,由总反应式减去负极反应式可得放电时的正极反应式为Li1-xMnO4+xLi++xe-═LiMnO4,
故答案为:Li1-xMnO4+xLi++xe-═LiMnO4;
②充电时,若转移1mole-,则石墨电极上产生1molLi,质量为1mol×7g/mol=7g,
故答案为:7.
点评 本题考查了物质生产流程的分析判断,流程分析,为高频考点,侧重学生的分析、实验能力的考查,把握物质性质的应用是解题关键,答题时注意把握题给信息,难度中等.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案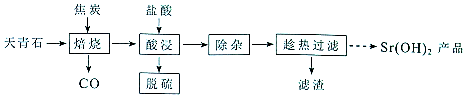
已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶解度(g/100mL) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaOH溶液调节pH为12.
①95℃时水的离子积KW=1.0×10-12,Ksp[Mg(OH)2]=1.2×10-10,则溶液中c(Mg2+)=1.2×10-10.
②若pH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,导致氢氧化锶沉淀析出.
(3)“趁热过滤”的目的是防止温度降低氢氧化锶析出造成产品的损失,可使钙离子尽可能转化为Ca(OH)2.“滤渣”的主要成分为Mg(OH)2、Mg(OH)2.
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶或冷却结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCI3溶液吸收酸浸产生的气体,吸收时的氧化产物为S(填化学式):再用石墨电极电解吸收液,电解后可在“脱硫”中循环利用的物质是FeCl3.
| A. | 合成氨工业:温度控制在500℃左右 | |
| B. | 接触法制硫酸:SO2在常压下催化氧化 | |
| C. | 侯氏制碱法:往母液中继续加入食盐和氨气 | |
| D. | 石油化工:将分馏得到的重油在高温下裂化 |
| A. | 第IA的元素全部是金属元素 | |
| B. | 元素周期表有18个族 | |
| C. | 元素周期表含元素最多的族是第ⅢB族 | |
| D. | 短周期是指第一、二、三、四周期 |
| A. | 用小苏打治疗胃酸过多:CO32-+2H+=CO2↑+H2O | |
| B. | 稀硝酸中加入过量的铁粉:Fe+4H++NO3-=Fe2++NO↑+2H2O | |
| C. | Ba(HCO3)2溶液中加入过量的NaOH溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32- | |
| D. | 用惰性电极电解饱和氯化镁溶液:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ |
| A. | 2NH3+H2SO4(浓)═(NH4)2SO4 | |
| B. | C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CO2↑+2SO2↑+2H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | 2FeO+4H2SO4(浓)═Fe2(SO4)3+SO2↑+4H2O |
| 编号 | ① | ② | ③ | ④ |
| 装置 | 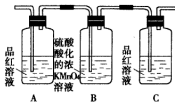 | 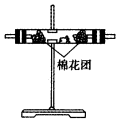 | 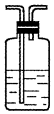 |  |
(3)A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,装置②中所加固体药品是(化学式)CuSO4.
(4)装置③中所盛溶液是澄清石灰水,反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O.证明有二氧化碳生成的实验现象是C瓶中品红溶液不褪色,③中澄清石灰水变为浑浊
(5)装置B中溶液逐渐褪色,生成Mn2+,同时pH降低,则该反应的离子方程式是5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+.
| A. | 分子间作用力 | B. | 氢键 | C. | 非极性共价键 | D. | 极性共价键 |
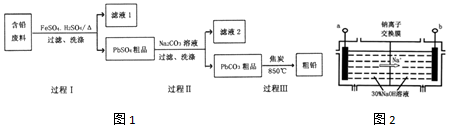
已知:Ksp(PbSO4)=1.6×10-5,Ksp(PbCO3)=3.3×10-14.
(1)过程I中,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是Pb+PbO2+2H2SO4$\frac{\underline{\;Fe_{2}+\;}}{\;}$2PbSO4+2H2O.
(2)过程I中,Fe2+催化过程可表示为:
i.2Fe2++PbO2+4H++SO42-═2Fe3++PbSO4+2H2O
ii.….
①写出ii的离子方程式:2Fe3++Pb+SO42-=PbSO4+2Fe2+;
②下列实验方案可证实上述催化过程.将实验方案补充完整.
| 编号 | 实验操作 | 现象 |
| 步骤1 | 向酸化的FeSO4溶液中加入KSCN溶液 | 溶液几乎无色 |
| 步骤2 | 取步骤1中反应液少量,加入少量PbO2,充分反应 | 溶液变红 |
| 步骤3 | 取步骤2中反应液少量,加入足量Pb,充分反应 | 红色褪去 |
(4)钠离子交换膜固相电解法是从含铅废料中提取铅的一种新工艺,其装置如图2所示.将含铅废料投入阴极室,含铅废料中的PbSO4与NaOH溶液发生反应:PbSO4+3OH-═HPbO2-+SO42-+H2O.
①b与外接电源的负极相连;
②电解过程中,PbO2、PbO、HPbO2-在阴极放电,其中PbO2放电的电极反应式为PbO2+4e-+2H2O=Pb+4OH-;
③与传统无膜固相电解法相比,使用钠离子交换膜可以提高Pb元素的利用率,原因是阻止HPbO2-进入阳极室被氧化.