题目内容
16.构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是( )| A. | E(3s)>E(3p)>E(3d) | B. | E(3s)>E(2s)>E(2 p) | C. | E(4f)>E(3d)>E(4s) | D. | E(5s)>E(4s)>E(4f) |
分析 各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,.在原子核外电子排布中,能量大小顺序是1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f…,据此分析解答.
解答 解:各能级能量高低顺序为①相同n而不同能级的能量高低顺序为:ns<np<nd<nf,②n不同时的能量高低:2s<3s<4s 2p<3p<4p;③不同层不同能级ns<(n-2)f<(n-1)d<np,绝大多数基态原子核外电子的排布都遵循下列顺序:1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f…,
A.同一能层中,能量从小到大顺序是ns<np<nd,所以E(3s)<E(3p)<E(3d),故A错误;
B.能级名称相同时,能层越大其能量越大,所以<E(2s)<E(3s),相同n而不同能级,E(2p)>E(2s )故B错误;
C.根据能量顺序1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f知,所以E(4f)>E(3d)>E(4s),故C正确;
D.根据能量顺序1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f知,E(4f)>E(5s)>E(4s),故D错误;
故选C.
点评 本题考查原子核外电子中能量大小比较,明确不同能层、相同能层、不同能级等电子能量大小是解本题关键,会根据构造原理书写原子核外电子排布式,难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
1.下列说法正确的是( )
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 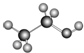 可以表示乙醇分子的球棍模型 可以表示乙醇分子的球棍模型 | |
| D. |  :既可以表示甲烷分子,也可以表示四氯化碳分子 :既可以表示甲烷分子,也可以表示四氯化碳分子 |
5.下列反应的离子方程式书写正确的是( )
| A. | 铜溶于0.5 mol﹒L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工业上将Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 1.0mol/L的NaAlO2溶液和2.5mol/L的盐酸等体积混合:2AlO2-+5H+═Al3++Al(OH)3↓+H2O |
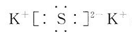 ,A属于离子化合物.
,A属于离子化合物.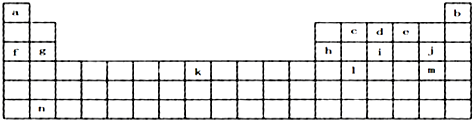
 ,元素c在周期表的位置第二周期IVA族
,元素c在周期表的位置第二周期IVA族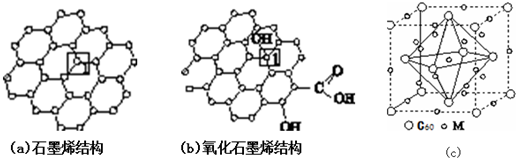
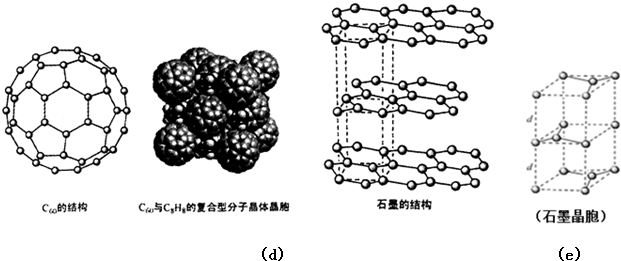
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60