题目内容
19.X、Y、Z、W四种短周期元素在元素周期表中序数逐渐增大.X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素.W原子的质子数等于Y、Z原子最外层电子数之和.Y的氢化物分子中有3个共价键.Z原子最外层电子数是次外层电子数的3倍.试推断:X、Y、Z的元素符号分别是:C、N、O.分析 X、Y、Z、W四种短周期元素在元素周期表中序数逐渐增大.Z原子最外层电子数是次外层电子数的3倍,可知次外层电子为2,最外层电子为6,即Z为O元素;X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,氢化物为氨气,可知X为C元素,Y为N元素,W为Si元素,符合W原子的质子数等于Y、Z原子最外层电子数之和,W的质子数为14,以此来解答.
解答 解:X、Y、Z、W四种短周期元素在元素周期表中序数逐渐增大.Z原子最外层电子数是次外层电子数的3倍,可知次外层电子为2,最外层电子为6,即Z为O元素;X为非金属元素,且X、W同主族,Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,氢化物为氨气,可知X为C元素,Y为N元素,W为Si元素,符合W原子的质子数等于Y、Z原子最外层电子数之和,W的质子数为14,
由上述分析可知,X为C,Y为N,Z为O,
故答案为:C;N;O.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意Z为O为突破口,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
9.下列说法中,不正确的是( )
| A. | 有机化学是研究有机物的组成、结构、性质、制备方法与应用的科学 | |
| B. | CO、H2CO3等含碳元素的化合物视作无机物的理由是他们的组成和性质跟无机物相似 | |
| C. | 迄今为止,人类发现和合成的有机物已超过3000万种 | |
| D. | 有机物受热不易分解,且不易燃烧 |
10.有一可逆反应2A(g)+3B(g)?4C(g)+D(g),已知起始浓度c(A)=2mol/L,c(B)=3mol/L,c(C)=c(D)=0,反应开始20min后达到平衡状态,此时D的平衡浓度为0.5mol/L,则下列说法不正确的是( )
| A. | 前20 min的平均反应速度$\overline v$(C)=0.1 mol/(L•min) | |
| B. | A的转化率为50% | |
| C. | C的平衡浓度c(C)=4 mol/L | |
| D. | B的平衡浓度c(B)=1.0 mol/L |
7.将1molE2(g)和1molF2(g)置于1L恒容密闭容器中,在一定条件下发生反应:aE2(g)+bF2(g)=cQ(g).当进行到Q的体积分数不再改变时,测得容器内c(E2)=0.9mol•L-1,c(F2)=0.8mol•L-1,c(Q)=0.2mol•L-1.则Q的化学式为( )
| A. | E2F2 | B. | E2F3 | C. | EF3 | D. | EF2 |
14.下列烷烃的系统命名中,不正确的是( )
| A. | 3,4-二甲基戊烷 | B. | 2,3-二甲基丁烷 | ||
| C. | 2,2-二甲基丁烷 | D. | 2,2,3,3-四甲基丁烷 |
4.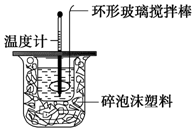 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=4.18J•g-1•℃-1.则中和热△H=-53.5kJ•mol-1(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):abe.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ•mol-1):H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-114.6kJ•mol-1.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2S O4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)abcd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
11.下列叙述正确的是( )
| A. | 标准状况下,相同体积的SO2和SO3,质量比为4:5 | |
| B. | 相同状况下,质量相同的O2和O3,密度之比为3:2 | |
| C. | 相同质量的金刚石和石墨含有相同的C原子数和共价键数 | |
| D. | 标准状况下,相同体积的C2H2和C2H4,密度比为13:14 |
9.用化学用语解释相关现象正确的是( )
| A. | BaSO4的水溶液导电性极弱:BaSO4?Ba2++SO42- | |
| B. | KHSO4在熔融状态下可导电:KHSO4=K++H++SO42+ | |
| C. | 常温下,0.1 mol/L的HF 溶液的pH>1:HF+H2O?H3O++F- | |
| D. | 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH- |