题目内容
12.碘化钠是实验室中常见的分析试剂,常用于医疗和照相业.工业上通常用水合肼(N2H4•H2O)还原法制取碘化钠,工艺流程如下:]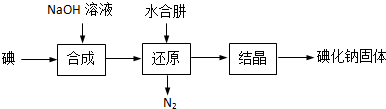
(1)合成过程的反应产物中含有IO3-,写出合成过程的离子方程式3I2+6OH-=5I-+IO3-+3H2O.
(2)工业上也可以用Na2S或Fe屑还原制备碘化钠,但水合肼还原法制得的产品纯度更高,原因是N2H4•H2O的氧化产物为N2和H2O.
(3)请补充完整检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-.实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液.
(4)测定产品中NI含量的实验步骤如下:
a.称4.000g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.用0.1000mol•L-1AgNO3溶液滴定至终点记录消耗AgNO3溶液的体积;
d.重复b、c操作2~3次,记录相关实验数据.
①滴定过程中,AgNO3溶液应放在酸式滴定管中;步骤d的目的是减少实验误差.
②若用上述方法测定产品中的NaI含量偏低(忽略测定过程中的误差),其可能的原因是部分NaI被空气中O2氧化.
分析 合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)根据发生的反应改写为离子方程式;
(2)N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质;
(3)加入淀粉溶液,加盐酸酸化,若含有IO3-,会与I-反应生成I2,淀粉遇碘变蓝色;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差;
②部分NaI被空气中O2氧化.
解答 解:合成过程的反应产物中含有IO3-,发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,加入水合肼得到氮气与NaI,即发生反应:3N2H4•H2O+2NaIO3=2NaI+3N2↑+9H2O,得到的NaI溶液经蒸发浓缩、冷却结晶可得到NaI.
(1)发生反应:3I2+6NaOH=5NaI+NaIO3+3H2O,离子方程式为3I2+6OH-=5I-+IO3-+3H2O,故答案为:3I2+6OH-=5I-+IO3-+3H2O;
(2)N2H4•H2O的氧化产物为N2和H2O,而用Na2S或Fe屑还原会得到其它杂质,水合肼还原法制得的产品纯度更高,
故答案为:N2H4•H2O的氧化产物为N2和H2O;
(3)检验还原液中是否含有IO3-的实验方案:取适量还原液,加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-,
故答案为:加入淀粉溶液,加盐酸酸化,若溶液变蓝色,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含IO3-;
(4)①稀溶液溶液呈酸性,应放在酸式滴定管中;重复操作,减少实验误差,
故答案为:酸式滴定管;减少实验误差;
②部分NaI被空气中O2氧化,导致滴定消耗硝酸银溶液偏小,测定产品中的NaI含量偏低,
故答案为:部分NaI被空气中O2氧化.
点评 本题考查物质制备实验,明确制备流程中发生的反应是解题关键,注意对题目信息的提取应用,题目难度中等.

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O | |
| C. | 向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| D. | Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+═SO42-+3S↓+2H2O |
| A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
| A. | 先后通入溴水和澄清石灰水 | |
| B. | 点燃后罩上涂有澄清石灰水的烧杯,通入溴水 | |
| C. | 点燃后罩上干燥的冷烧杯 | |
| D. | 点燃后罩上涂有澄清石灰水的烧杯 |
| A. | 44.5kJ/mol | B. | 1364.7kJ/mol | C. | 2729.3kJ/mol | D. | 89.0kJ/mol |
| A. | 溶液中一定含Cu2+和Fe2+ | B. | 溶液中一定含Cu2+和Fe3+ | ||
| C. | 溶液中一定含 Fe3+和Fe2+ | D. | 溶液中一定含Fe3+、Cu2+和Fe2+ |
| A. | SO2既是氧化产物又是还原产物 | |
| B. | CuFeS2既是氧化剂又是还原剂,其中硫元素被还原 | |
| C. | FeS既不是氧化产物也不是还原产物 | |
| D. | 在转移了3mol电子的同时,有0.5 mol的SO2生成 |
| A. | 钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水 | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为O2+2H2O+4e-═4OH- | |
| C. | 在海轮外壳上镶入锌块,锌作负极,可减缓船体的腐蚀速率 | |
| D. | 在潮湿的空气中,镀锌铁板比镀锡铁板更耐腐蚀 |