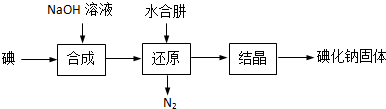
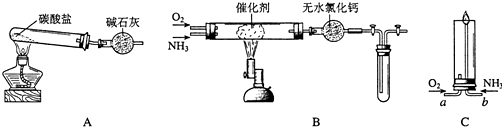
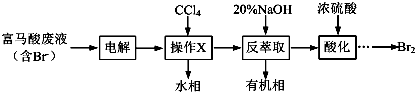
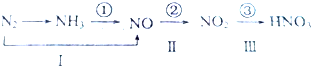题目内容
2.一定温度下,向1L 0.l mol•L-1 CH3COOH溶液中加入0.1molCH3COONa固体,溶液中$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$不变(填“增大”、“减小”或“不变”).分析 醋酸的电离平衡常数K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$,该表达式只受温度影响,定温度下,向1L 0.l mol•L-1 CH3COOH溶液中加入0.1molCH3COONa固体,由于温度不变,则该比值不变.
解答 解:K=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$为CH3COOH的电离平衡常数,该比值只受温度的影响,
由于混合过程中溶液温度不变,则醋酸的电离平衡常数不变,故$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$的比值不变,
故答案为:不变.
点评 本题考查了电离平衡常数及其影响,题目难度不大,明确电离平衡常数的概念及表达式为解答关键,注意掌握影响电离平衡常数的因素,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案
相关题目
10.有关NaHCO3和Na2CO3的叙述不正确的是( )
| A. | 等质量NaHCO3和Na2CO3的分别与足量盐酸完全反应,Na2CO3产生的CO2少 | |
| B. | 84g NaHCO3、106g Na2CO3分别与同浓度足量盐酸完全反应,Na2CO3消耗盐酸的是NaHCO3两倍 | |
| C. | 将澄清石灰水、CaCl2溶液分别倒入两种盐溶液中,都只有Na2CO3产生沉淀 | |
| D. | 通常情况下,Na2CO3的溶解度大于NaHCO3 |
11.下列各组离子,在同一溶液中能大量共存的是( )
| A. | Ca2+、Na+、Cl-、NO${\;}_{3}^{-}$ | B. | H+、Na+、Cl-、CO32- | ||
| C. | Na+、Ag+、Cl-、OH- | D. | Na+、Ca2+、Cl-、CO32- |