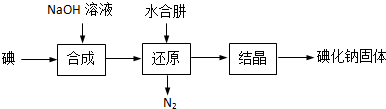
题目内容
3.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是( )| A. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| B. | 温度升高到50℃,两溶液的pH均不会发生变化 | |
| C. | 用同浓度的盐酸中和,消耗的盐酸体积相同 | |
| D. | 分别加水稀释到10倍体积,稀释后两溶液的pH仍相等 |
分析 一水合氨是弱碱、NaOH是强碱,pH相同的c(NH3.H2O)>c(NaOH),室温下pH相同体积相同的氨水和氢氧化钠溶液中n(NH3.H2O)>n(NaOH),
A.氯化铵溶液中铵根离子抑制一水合氨电离,所以氨水中加入适量氯化铵晶体后溶液pH减小;NaOH和铵根离子水解生成的氢离子反应导致NaOH溶液中c(OH-)减小;
B.升高温度促进一水合氨电离;
C.用同浓度的盐酸中和,消耗的盐酸体积与碱的物质的量成正比;
D.加水稀释促进弱电解质电离,所以能促进一水合氨电离,NaOH完全电离不存在电离平衡.
解答 解:一水合氨是弱碱、NaOH是强碱,pH相同的c(NH3.H2O)>c(NaOH),室温下pH相同体积相同的氨水和氢氧化钠溶液中n(NH3.H2O)>n(NaOH),
A.氯化铵溶液中铵根离子抑制一水合氨电离,所以氨水中加入适量氯化铵晶体后溶液pH减小;NaOH和铵根离子水解生成的氢离子反应导致NaOH溶液中c(OH-)减小,溶液的pH减小,故A正确;
B.升高温度促进一水合氨电离,导致氨水中c(OH-)增大,氨水的pH增大;NaOH是强电解质,不存在电离平衡,升高温度溶液中c(OH-)不变,但溶液的离子积常数增大,c(H+)增大,溶液的pH增大,故B错误;
C.用同浓度的盐酸中和,消耗的盐酸体积与碱的物质的量成正比,因为n(NH3.H2O)>n(NaOH),
所以氨水消耗盐酸体积多,故C错误;
D.加水稀释促进弱电解质电离,所以能促进一水合氨电离,NaOH完全电离不存在电离平衡,稀释后两种溶液中c(OH-)都减小,但氨水中c(OH-)大于NaOH,所以pH氨水大于NaOH,故D错误;
故选A.
点评 本题考查弱电解质的电离,为高频考点,明确弱电解质的电离特点是解本题关键,易错选项是B,升高温度NaOH浓度不变但水的离子积常数增大会导致溶液的pH增大,如果是强酸溶液,升高温度溶液的pH基本不变,为易错点.

 能力评价系列答案
能力评价系列答案| A. | 明矾净水是利用了明矾的强氧化性 | |
| B. | 溶液的焰色反应为紫色,这是化学性质 | |
| C. | 加入Ba(OH)2溶液至沉淀物质的量达到最大,消耗Ba(OH)2溶液0.2mol | |
| D. | 加入Ba(OH)2溶液至SO42-恰好完全沉淀,Al3+全部转化为AlO2- |
| A. | 糖类是动、植物所需能量的重要来源,油脂是产生能量最高的营养物质 | |
| B. | 化石燃料的大量使用是产生PM2.5的主要原因之一 | |
| C. | 碳酸钠俗名纯碱,也叫苏打,可用于清洗厨房用具的油污 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是铝合金 |
| A. | 在室温和常压下,71 g Cl2含有2NA个Cl原子 | |
| B. | 在同温、同压下,相同体积的任何气体,所含分子数和原子数都相同 | |
| C. | 物质的量浓度为1 mol/L的K2SO4溶液中,含2NA个K+ | |
| D. | 100g 98%的硫酸溶液中所含氢原子的数目为2NA |
| A. | 0.01 mol•L-1的H2A溶液 | |
| B. | 0.01 mol•L-1NaHA溶液 | |
| C. | 0.02 mol•L-1HCl溶液与0.04 mol•L-1NaHA溶液等体积混合 | |
| D. | 0.02mol•L-1 NaOH溶液0.02 mol•L-1 NaHA溶液等体积混合 |
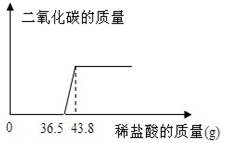 欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下:
欲测定某氢氧化钠样品中可能的变质成分碳酸钠的含量,张同学取该样品少量放于烧杯中,向其中慢慢滴加10%的稀盐酸,所加盐酸与产生气体的质量关系图如下: