题目内容
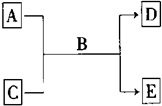 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:(1)若A为短周期的金属单质,D为气态单质,0.1mol/L C溶液的pH=13.该反应的离子方程式为
(2)若A的溶液能使淀粉溶液变蓝;C为非金属氧化物,能使品红溶液褪色,该反应的反应方程式为
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,该反应的离子方程式为
(4)若A是黄绿色气体; C的焰色呈黄色,C溶液遇稀硫酸既产生淡黄色的沉淀又生成有刺激性气味的无色气体;生成物D是一种酸式盐,E是一种强酸.该反应的化学方程式为
考点:无机物的推断
专题:推断题
分析:A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,判断为H2O;
(1)若A为短周期的金属单质,0.1mol/L C溶液的pH=13,说明C为强碱性溶液,D为气态单质,判断A为Al,D为H2;
(2)若A的溶液能使淀粉溶液变蓝,A具有氧化性,C为非金属氧化物,能使品红溶液褪色,则C为二氧化硫,则A为氯气;
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠;
(4)若A是黄绿色气体,则A为氯气,C的焰色呈黄色,说明C中含有钠元素,C溶液遇稀硫酸既产生淡黄色的沉淀又生成有刺激性气味的无色气体,则C为硫代硫酸钠;生成物D是一种酸式盐是硫酸氢钠,E是一种强酸,则E为盐酸,据此答题.
(1)若A为短周期的金属单质,0.1mol/L C溶液的pH=13,说明C为强碱性溶液,D为气态单质,判断A为Al,D为H2;
(2)若A的溶液能使淀粉溶液变蓝,A具有氧化性,C为非金属氧化物,能使品红溶液褪色,则C为二氧化硫,则A为氯气;
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠;
(4)若A是黄绿色气体,则A为氯气,C的焰色呈黄色,说明C中含有钠元素,C溶液遇稀硫酸既产生淡黄色的沉淀又生成有刺激性气味的无色气体,则C为硫代硫酸钠;生成物D是一种酸式盐是硫酸氢钠,E是一种强酸,则E为盐酸,据此答题.
解答:
解:A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,判断为H2O;
(1)若A为短周期的金属单质,0.1mol/L C溶液的pH=13,说明C为强碱性溶液,D为气态单质,判断A为Al,D为H2,该反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)若A的溶液能使淀粉溶液变蓝,A具有氧化性,C为非金属氧化物,能使品红溶液褪色,则C为二氧化硫,则A为氯气,该反应的反应方程式为SO2+Cl2+2H2O═2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O═2HCl+H2SO4;
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠,该反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O═4Al(OH)3↓;
(4)若A是黄绿色气体,则A为氯气,C的焰色呈黄色,说明C中含有钠元素,C溶液遇稀硫酸既产生淡黄色的沉淀又生成有刺激性气味的无色气体,则C为硫代硫酸钠;生成物D是一种酸式盐是硫酸氢钠,E是一种强酸,则E为盐酸,该反应的化学方程式为S2O32-+Cl2+H2O═2H++2Cl-+SO4 2-+S↓,为检验反应后溶液中E电离出的阴离子为氯离子,实验方法是滴加硝酸银和稀硝酸,看是否有有溶于硝酸的白色沉淀产生,如果有则说明有氯离子,如果没有则没有氯离子,
故答案为:S2O32-+Cl2+H2O═2H++2Cl-+SO4 2-+S↓;滴加硝酸银和稀硝酸,看是否有有溶于硝酸的白色沉淀产生,如果有则说明有氯离子,如果没有则没有氯离子.
(1)若A为短周期的金属单质,0.1mol/L C溶液的pH=13,说明C为强碱性溶液,D为气态单质,判断A为Al,D为H2,该反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)若A的溶液能使淀粉溶液变蓝,A具有氧化性,C为非金属氧化物,能使品红溶液褪色,则C为二氧化硫,则A为氯气,该反应的反应方程式为SO2+Cl2+2H2O═2HCl+H2SO4,
故答案为:SO2+Cl2+2H2O═2HCl+H2SO4;
(3)若A、C、D、E均为化合物,E为白色沉淀,且A、C、E含有同一种元素,则A为氯化铝,C为偏铝酸钠,E为Al(OH)3、D为氯化钠,该反应的离子方程式为Al3++3AlO2-+6H2O═4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O═4Al(OH)3↓;
(4)若A是黄绿色气体,则A为氯气,C的焰色呈黄色,说明C中含有钠元素,C溶液遇稀硫酸既产生淡黄色的沉淀又生成有刺激性气味的无色气体,则C为硫代硫酸钠;生成物D是一种酸式盐是硫酸氢钠,E是一种强酸,则E为盐酸,该反应的化学方程式为S2O32-+Cl2+H2O═2H++2Cl-+SO4 2-+S↓,为检验反应后溶液中E电离出的阴离子为氯离子,实验方法是滴加硝酸银和稀硝酸,看是否有有溶于硝酸的白色沉淀产生,如果有则说明有氯离子,如果没有则没有氯离子,
故答案为:S2O32-+Cl2+H2O═2H++2Cl-+SO4 2-+S↓;滴加硝酸银和稀硝酸,看是否有有溶于硝酸的白色沉淀产生,如果有则说明有氯离子,如果没有则没有氯离子.
点评:本题考查了物质转化关系的应用,物质性质和反应条件的应用判断,主要考查氯气、硫及其化合物、铝及其化合物等物质性质的推断和运用,题目难度中等.

练习册系列答案
相关题目
化学在人类生活中扮演着重要角色,以下说法或应用正确的是( )
| A、尿素是人类第一次合成的蛋白质 |
| B、光导纤维和合成纤维都属于有机高分子材料 |
| C、苯、汽油、无水乙醇都是纯净物 |
| D、煤经气化和液化两个化学变化过程,可变为清洁能源 |
 国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )
国庆期间对天安门广场大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,下列关于该物质的说法正确的是( )| A、其分子式为C15H18O4 |
| B、1mol该物质与NaOH溶液反应,最多可消耗2mol NaOH |
| C、既能发生加成反应,又能发生取代反应和消去反应 |
| D、既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |
下列有关实验原理或实验操作正确的是( )


| A、用干燥pH试纸测定某新制氯水的pH |
| B、用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| C、用图1装置除去乙烷中混有的乙烯 |
| D、用图2装置能验证HCl气体在水中的溶解性 |

 已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2
已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2