题目内容
 已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2
已知亚铝酸钠(NaClO2)为白色粉末,易溶于水,NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,在38-60℃时析出的晶体是NaClO2,高于60℃时NaClO3和NaCl,某同学利用如图所示装置制备亚铝酸钠,并进行一系列的探究.
(1)②中生成的气体为ClO2,是有强烈刺激性臭味的红黄色有毒气体,装置①的作用是
(2)④中发生反应的离子方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶,②
(4)简述验证NaClO2,热不稳定性的实验方案:
(5)产品纯度测定:
①准确称取所得亚氯酸钠样品10.0g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(ClO2-+4I-+4H+═2H2O+2I2+Cl-),将所得混合液配成250mL待测溶液,配制待测液需用的定量玻璃仪器是
②取25.00mL待测液,用2.0mol?L-1的Na2S2O4标准液滴定(I2+2S2O32-═2I-+S4O32-),以淀粉溶液作指示剂,达到滴定终点时的现象为
考点:制备实验方案的设计
专题:实验题
分析:(1)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气.装置③为安全瓶,防止装置②中气体温度降低而产生倒吸;
(2)④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(4)验证NaClO2,热不稳定性的实验方案可以是利用试剂检验是否生成氯离子;
(5)①配制溶液的定量仪器是容量瓶,容量瓶要指明规格;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=
n(S2O32-)=
×20×10-3×2=0.01mol,m(NaClO2)=0.01×90.5=9.05g,计算得到样品中NaClO2的质量分数;
(2)④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤;
(4)验证NaClO2,热不稳定性的实验方案可以是利用试剂检验是否生成氯离子;
(5)①配制溶液的定量仪器是容量瓶,容量瓶要指明规格;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-,n(ClO2-)=
| 1 |
| 1 |
| 4 |
解答:
解:(1)本实验产生污染性气体,直接排放会污染环境,故需要尾气处理,装置①就是用碱吸收反应产生的ClO2等尾气,当关闭K2时,打开K1,可以吸收反应产生的气体,装置③为安全瓶,防止装置②中气体温度降低而产生倒吸,
故答案为:当关闭K2时,打开K1,可以吸收反应产生的剩余气体,防止倒吸;
(2)④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;反应的离子方程式为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
故答案为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤,
故答案为:趁热过滤;用38-60℃的温水洗涤;
(4)验证NaClO2,热不稳定性的实验方案可以是利用试剂检验是否生成氯离子,方案为:取少许NaClO2样品,对其加热至60°C,一定时间后将固体溶于适量水中,滴加硝酸酸化的硝酸银,若生成白色沉淀,说明其不稳定;
故答案为:取少许NaClO2样品,对其加热至60°C,一定时间后将固体溶于适量水中,滴加硝酸酸化的硝酸银,若生成白色沉淀,说明其不稳定;
(5)①将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,
故答案为:250mL容量瓶;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=
n(S2O32-)=
×20×10-3×2=0.01mol
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=
×100%=90.5%;
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
故答案为:当关闭K2时,打开K1,可以吸收反应产生的剩余气体,防止倒吸;
(2)④中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应生成NaClO2,O2和H2O;反应的离子方程式为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
故答案为:2ClO2+2OH-+H2O2=2ClO2-+2H2O+O2;
(3)因为NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2?3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl,若要得到NaClO2晶体,需在38-60℃得到晶体,故操作为趁热过滤;用38-60℃的温水洗涤,
故答案为:趁热过滤;用38-60℃的温水洗涤;
(4)验证NaClO2,热不稳定性的实验方案可以是利用试剂检验是否生成氯离子,方案为:取少许NaClO2样品,对其加热至60°C,一定时间后将固体溶于适量水中,滴加硝酸酸化的硝酸银,若生成白色沉淀,说明其不稳定;
故答案为:取少许NaClO2样品,对其加热至60°C,一定时间后将固体溶于适量水中,滴加硝酸酸化的硝酸银,若生成白色沉淀,说明其不稳定;
(5)①将所得混合液配成250mL待测溶液.配制待测液需用到的定量玻璃仪器是250mL容量瓶,容量瓶要指明规格,则选择250mL容量瓶,
故答案为:250mL容量瓶;
②有碘单质参和生成的反应,一般采用淀粉溶液做指示剂,该反应是Na2S2O3标准液滴定碘,滴入最后一滴Na2S2O3标准液,终点溶液由蓝色变为无色且半分钟内不变色;
计算时一般找出关系式,由此进行计算,关系式为ClO2---2I2--4S2O32-
n(ClO2-)=
| 1 |
| 4 |
| 1 |
| 4 |
m(NaClO2)=0.01×90.5=9.05g,
计算得到样品中NaClO2的质量分数=
| 9.05g |
| 10g |
故答案为:滴入最后一滴Na2S2O3标准液由蓝色变为无色且半分钟内不变色;90.5%;
点评:本题考查了物质制备的实验工厂、实验步骤、实验仪器的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
下列关于平衡常数的说法中,正确的是( )
| A、在平衡常数的表达式中,反应物用起始浓度,生成物用平衡浓度 |
| B、在任何条件下,一个化学反应的平衡常数都不会改变 |
| C、平衡常数的大小仅跟温度有关,与浓度、压强、催化剂等无关 |
| D、平衡常数越大,化学反应速率越快 |
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示.下列说法不正确的是( )

| A、去甲肾上腺素分子组成为C8H10NO3 |
| B、去甲肾上腺素分子可以发生取代、加成、消去、缩聚等反应 |
| C、每个去甲肾上腺素分子中含有2个手性碳原子 |
| D、去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
要提纯下列物质(括号内为杂质),所用试剂正确的是( )
| A、KCl(MgCl2)--加过量KOH溶液 |
| B、CO2(SO2)--通过足量NaOH溶液 |
| C、MnO2(KClO3)--加足量的水 |
| D、Na2CO3(Na2SO4)--加足量的BaCl2 溶液 |
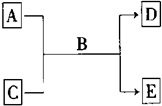 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: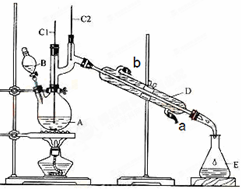 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下: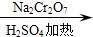 CH3CH2CH2CHO
CH3CH2CH2CHO