题目内容
重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成份为FeO?Cr2O3,以及SiO2、Al2O3等杂质)为原料生产,实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:

反应器中主要发生的反应为:
Ⅰ.FeO?Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2
Na2SiO3+CO2↑
Ⅲ.Al2O3+2NaOH
2NaAlO2+H2O
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去.
(1)在反应Ⅰ中氧化剂是 ,若有245g KClO3参加反应,则转移的电子数为 .
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式 .
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为 ,离子方程式为 .
(4)请选用合适的方法进一步提纯粗产品重铬酸钾 (填字母)
A.重结晶 B.萃取分液 C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式 .

反应器中主要发生的反应为:
Ⅰ.FeO?Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平)
Ⅱ.Na2CO3+SiO2
| ||
Ⅲ.Al2O3+2NaOH
| ||
在步骤③中将溶液pH调节到7~8可以将SiO32-和AlO2-转化为相应的沉淀除去.
(1)在反应Ⅰ中氧化剂是
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111g/mol的化合物,能强烈水解,在操作②生成沉淀而除去,写出生成该化合物的化学反应方程式
(3)操作④目的是将CrO42-转化为Cr2O72-,其现象为
(4)请选用合适的方法进一步提纯粗产品重铬酸钾
A.重结晶 B.萃取分液 C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量,写出酸化的K2Cr2O7与KI反应的化学方程式
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)氧化剂是反应中化合价降低的物质,在反应Ⅰ中KClO3中的氯元素化合价从+5降到-1,为氧化剂,245g KClO3的物质的量为2mol,则转移电子的物质的量为12mol,即12 NA;
(2)Fe2O3和Na2CO3反应,产物中应有CO2,另一种产物中含有钠、铁元素,结合摩尔质量为111g/mol,推出该化合物的化学式为NaFeO2,所以生成该化合物的化学反应方程式Fe2O3+Na2CO3=2NaFeO2+CO2↑;
(3)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O;
(4)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择A;
(5)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
(2)Fe2O3和Na2CO3反应,产物中应有CO2,另一种产物中含有钠、铁元素,结合摩尔质量为111g/mol,推出该化合物的化学式为NaFeO2,所以生成该化合物的化学反应方程式Fe2O3+Na2CO3=2NaFeO2+CO2↑;
(3)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O;
(4)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择A;
(5)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
解答:
解:(1)氧化剂是反应中化合价降低的物质,在反应Ⅰ中KClO3中的氯元素化合价从+5降到-1,为氧化剂,245g KClO3的物质的量为2mol,则转移电子的物质的量为12mol,即12 NA;故答案为:KClO3;12NA;
(2)Fe2O3和Na2CO3反应,产物中应有CO2,另一种产物中含有钠、铁元素,结合摩尔质量为111g/mol,推出该化合物的化学式为NaFeO2,所以生成该化合物的化学反应方程式Fe2O3+Na2CO3
2NaFeO2+CO2↑;
故答案为:Fe2O3+Na2CO3
2NaFeO2+CO2↑;
(3)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O;
故答案为:溶液由黄色变为橙色;2CrO42-+2H+=Cr2O72-+H2O;
(4)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择A;故答案为:A;
(5)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
故答案为:K2Cr2O7+7H2SO4+6KI=Cr2 (SO4)3+3I2+7H2O+4K2SO4.
(2)Fe2O3和Na2CO3反应,产物中应有CO2,另一种产物中含有钠、铁元素,结合摩尔质量为111g/mol,推出该化合物的化学式为NaFeO2,所以生成该化合物的化学反应方程式Fe2O3+Na2CO3
| ||
故答案为:Fe2O3+Na2CO3
| ||
(3)CrO42-、Cr2O72-的颜色分别为黄色、橙色,所以现象为溶液由黄色变为橙色,反应的离子方程式为 2CrO42-+2H+=Cr2O72-+H2O;
故答案为:溶液由黄色变为橙色;2CrO42-+2H+=Cr2O72-+H2O;
(4)萃取分液适用于互不相溶的液体,蒸馏适用于沸点相差较大的互溶液体,而重结晶法是利用物质不同温度下溶解度的不同,分离提纯待重结晶物质的过程,所以选择A;故答案为:A;
(5)硫酸酸化的K2Cr2O7与KI反应,根据氧化还原反应理论,得化学反应方程式K2Cr2O7+7H2SO4+6KI=Cr2(SO4)3+3I2+7H2O+4K2SO4.
故答案为:K2Cr2O7+7H2SO4+6KI=Cr2 (SO4)3+3I2+7H2O+4K2SO4.
点评:本考查氧化剂的判断、电子转移数目的计算、化学方程式的推断、离子方程式的书写以及物质提纯方法.

练习册系列答案
相关题目
NA为阿伏伽德罗常数,下列叙述不正确的是( )
| A、标况下,4.48L SO2中含O原子数为0.4NA |
| B、常温常压下,8.96LCO2中所含分子数为0.4 NA |
| C、500mL 0.1 mol/L的NaOH溶液中含OH-的数目为0.05NA |
| D、常温常压下,1.6g CH4中含H原子数为0.4NA |
完成下列实验所选择的装置或仪器(夹持装置已略去)正确的是( )
| A | B | C | D | |
| 实验 | 用CCl4提取溴水中的溴 | 除去乙醇中的I2 | 加热分解MgCl2?6H2O 得到纯净的MgCl2 | 配制100mL0.1000mol/L-1K2CR 2O溶 |
| 装置或仪器 |  |  |  |  |
| A、A | B、B | C、C | D、D |
要提纯下列物质(括号内为杂质),所用试剂正确的是( )
| A、KCl(MgCl2)--加过量KOH溶液 |
| B、CO2(SO2)--通过足量NaOH溶液 |
| C、MnO2(KClO3)--加足量的水 |
| D、Na2CO3(Na2SO4)--加足量的BaCl2 溶液 |
 已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:
已知:X、Y、Z、W是四种短周期元素,它们的原子序数依次增大.其中X、Y、Z同周期,X与W同主族;X与Z形成的常见化合物之一常被用于高炉炼铁,且X、Z原子的L层都有2个未成对电子;Q+离子M层3d轨道电子为全充满状态.请回答下列问题:
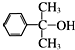 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是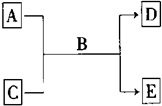 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: