题目内容
下图图Ⅰ是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置.
(1)从图Ⅱ中挑选所需仪器,在图Ⅰ的方框中补上所缺装置(添加必要的塞子、玻璃导管、胶皮管,固定装置不用画),并标明容器中所装试剂 .仪器组装好后,首先应进行的一项操作是 .
(2)固体KClO3与浓盐酸混合反应后可得到Cl2,补全下列离子方程式: Cl- + H +=3Cl2↑+ H2O;
(3)实验中,必须控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收.写出该反应的离子方程式 ,实验中可通过控制制气装置中的 来达到控制氯气逸出速度的目的.
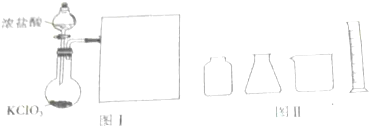
(1)从图Ⅱ中挑选所需仪器,在图Ⅰ的方框中补上所缺装置(添加必要的塞子、玻璃导管、胶皮管,固定装置不用画),并标明容器中所装试剂
(2)固体KClO3与浓盐酸混合反应后可得到Cl2,补全下列离子方程式:
(3)实验中,必须控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收.写出该反应的离子方程式

考点:氯气的实验室制法
专题:实验题
分析:(1)氯气通入氯化亚铁溶液反应,剩余的氯气不能排放空气中 需要尾气吸收装置,制备气体,应首先检验气密性;
(2)固体KClO3与浓HCl反应制备Cl2,反应的化学方程式为:KClO3+6HCl
KCl+3Cl2↑+3H2O;
(3)氯化亚铁可被氧化生成氯化铁,控制反应速率需要控制反应物的量以达到控制反应速率的目的.
(2)固体KClO3与浓HCl反应制备Cl2,反应的化学方程式为:KClO3+6HCl
| ||
(3)氯化亚铁可被氧化生成氯化铁,控制反应速率需要控制反应物的量以达到控制反应速率的目的.
解答:
解:(1)制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置需要把氯气通入氯化亚铁溶液中发生反应生成氯化铁,氯气有毒需要尾气吸收,据此设计选择装置为: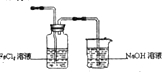 ,仪器组装好后,首先应进行的一项操作是检验装置的气密性,
,仪器组装好后,首先应进行的一项操作是检验装置的气密性,
故答案为: ;检验装置的气密性;
;检验装置的气密性;
(2)固体KClO3与浓HCl反应制备Cl2,反应的化学方程式为:KClO3+6HCl
KCl+3Cl2↑+3H2O,反应的离子方程式为ClO3-+6H++5Cl-
3Cl2↑+3H2O,
故答案为:5;ClO3-;5;3;
(3)氯化亚铁可被氧化生成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,控制生成氯气速率的操作是缓慢旋转分液漏斗的活塞,调节浓盐酸滴下的速度,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;活塞.
 ,仪器组装好后,首先应进行的一项操作是检验装置的气密性,
,仪器组装好后,首先应进行的一项操作是检验装置的气密性,故答案为:
 ;检验装置的气密性;
;检验装置的气密性;(2)固体KClO3与浓HCl反应制备Cl2,反应的化学方程式为:KClO3+6HCl
| ||
| ||
故答案为:5;ClO3-;5;3;
(3)氯化亚铁可被氧化生成氯化铁,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,控制生成氯气速率的操作是缓慢旋转分液漏斗的活塞,调节浓盐酸滴下的速度,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;活塞.
点评:本题考查了物质制备的实验方案设计和实验过程分析,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及实验的原理和操作方法,难度不大.

练习册系列答案
相关题目
日本福岛核电站发生核泄漏后,有不少居民误认为吃碘盐可以完全预防核辐射,从而在部分地区引发了不科学的抢盐风波.碘盐一般是含碘酸钾(KIO3)的食盐,在碘酸钾中碘(I)的化合价为( )
| A、-1 | B、+1 | C、+5 | D、+7 |
有机物甲的分子式为C9H18O2,在酸性条件下甲水解为乙和丙两种有机物,且乙和丙分子中含有数目的甲基,在相同的温度和压强下,同质量的乙和丙的蒸气所占体积相同,则甲的可能结构有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
下列实验基本操作(或实验注意事项)中,主要是出于实验安全考虑的是( )
| A、气体实验装置在实验前进行气密性检查 |
| B、可燃性气体点燃前需要验纯 |
| C、实验剩余的药品不能放回原试剂瓶 |
| D、滴管不能交叉使用 |
下列两种无色试剂,不用其它试剂无法鉴别的是( )
| A、NaHCO3、HCl |
| B、Na2CO3、HCl |
| C、NaAlO2、H2SO4 |
| D、AlCl3、NaOH |

 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是

 A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系:
A、B、C、D、E均为中学化学常见的纯净物,B为自然界中含量最多的液体,它们之间有如下的反应关系: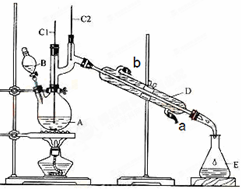 正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下:
正丁醛是一种化工原料.某实验小组利用如下装置合成正丁醛.发生的反应如下: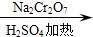 CH3CH2CH2CHO
CH3CH2CH2CHO