题目内容
工业上制备BaCl2的工艺流程图如下,某研究小组在实验室用重晶石(主要成分为BaSO4)对上述工业过程进行了模拟实验.
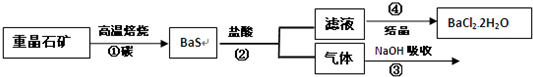
(1)步骤①中BaSO4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为 .
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
= .
【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)在实验室中BaCl2的重要用途之一是检验SO42-,要检验某无色溶液中含有SO42- 的操作方法是:取少量样品,先加入足量的 (填试剂名称),无明显现象,再滴加少量 (填试剂名称),若有白色沉淀产生,说明含有SO42-.
(4)将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体有沉淀生成,则后通入的气体不可能是 .
A.NH3 B.NO2 C.CO2 D.H2S
(5)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中阴离子浓度由大到小的顺序为 .
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时混合溶液的体积为100mL,且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为 mol/L.(保留小数点后三位)

(1)步骤①中BaSO4与碳在高温下反应,每1mol碳生成CO需要吸收142.8kJ的热量,此反应的热化学方程式为
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,
| c(Br-) |
| c(Cl-) |
【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)在实验室中BaCl2的重要用途之一是检验SO42-,要检验某无色溶液中含有SO42- 的操作方法是:取少量样品,先加入足量的
(4)将SO2通入BaCl2溶液至饱和,未见有沉淀,继续通入另一种气体有沉淀生成,则后通入的气体不可能是
A.NH3 B.NO2 C.CO2 D.H2S
(5)若NaOH溶液吸收H2S气体生成等物质的量的Na2S和NaHS,则溶液中阴离子浓度由大到小的顺序为
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,此时混合溶液的体积为100mL,且混合溶液的pH=2,则原BaCl2溶液中Cl-的浓度为
考点:金属的回收与环境、资源保护,热化学方程式,难溶电解质的溶解平衡及沉淀转化的本质,酸碱混合时的定性判断及有关ph的计算,物质的分离、提纯和除杂
专题:基本概念与基本理论,元素及其化合物
分析:(1)先写出方程式,再根据物质的量之比等于热量比求出反应热;
(2)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中
=
,依此计算;
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
(4)SO2气体通入BaCl2溶液中,未见白色沉淀,不发生反应,继续通入另一种气体立即产生沉淀,沉淀可能为硫酸钡或亚硫酸钡,也可能为S,则气体具有氧化性或碱性等,以此来解答.
(5)Na2S和NaHS的混合溶液显碱性,NaHS以水解为主,据此判断;
(6)反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,根据PH的定义,结合体积的变化情况来计算.
(2)当两种沉淀共存时,溶液是AgCl和AgBr的饱和溶液,溶液中
| C(Br -) |
| C(Cl -) |
| Ksp(AgBr) |
| Ksp(AgCl) |
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
(4)SO2气体通入BaCl2溶液中,未见白色沉淀,不发生反应,继续通入另一种气体立即产生沉淀,沉淀可能为硫酸钡或亚硫酸钡,也可能为S,则气体具有氧化性或碱性等,以此来解答.
(5)Na2S和NaHS的混合溶液显碱性,NaHS以水解为主,据此判断;
(6)反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,根据PH的定义,结合体积的变化情况来计算.
解答:
解:(1)BaSO4与碳在高温下反应的方程式为:BaSO4(s)+4C(s)═4CO(g)+BaS(s),每1mol碳生成CO需要吸收142.8kJ的热量,所以△H=+571.2kJ/mol,此反应的热化学方程为:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol,
故答案为:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
,c(Cl-)=
,
则
=
=
=2.7×10-3,
故答案为:2.7×10-3;
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
故答案为:稀盐酸;氯化钡;
(4)A.氨气与二氧化硫发生反应生成亚硫酸铵,亚硫酸铵与钡离子结合生成亚硫酸钡沉淀,故A不选;
B.二氧化氮通入溶液中生成硝酸,硝酸氧化二氧化硫反应生成硫酸根离子,与钡离子结合生成硫酸钡沉淀,故B不选;
C.二氧化碳、二氧化硫与氯化钡均不反应,不能生成沉淀,故C选;
D.二氧化硫与硫化氢发生氧化还原反应生成S沉淀,故D不选;
故选C.
(5)Na2S和NaHS的混合溶液显碱性即c(OH-)>c(H+),NaHS以水解为主,则c(HS-)>c(S2-),所以溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),所以阴离子的浓度由大到小的顺序为c(HS-)>c(S2-)>c(OH-),故答案为:c(HS-)>c(S2-)>c(OH-);
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,发生的是硫酸根和钡离子之间的反应,反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,则反应后H+的浓度是0.01mol/L,稀硫酸pH=1,故反应的稀硫酸为10ml,而SO42-的浓度是0.005 mol/L,
故Ba2+的物质的量等于SO42-的物质的量,为0.0005mol,所以Cl-的物质的量是0.001mol,BaCl2溶液为100mL-10mL=90mL,原BaCl2溶液中Cl-的浓度=
=0.011mol/L,故答案为:0.011.
故答案为:BaSO4(s)+4C(s)═4CO(g)+BaS(s)△H=+571.2kJ/mol;
(2)当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算,c(Br-)=
| Ksp(AgBr) |
| c(Ag +) |
| Ksp(AgCl) |
| c(Ag +) |
则
| C(Br -) |
| C(Cl -) |
| Ksp(AgBr) |
| Ksp(AgCl) |
| 5.4×10 -13 |
| 2.0×10 -10 |
故答案为:2.7×10-3;
(3)检验SO42- 的操作方法是:取少量样品,先加入足量的稀盐酸,无明显现象,再滴加少量氯化钡,若有白色沉淀产生,说明含有SO42-.
故答案为:稀盐酸;氯化钡;
(4)A.氨气与二氧化硫发生反应生成亚硫酸铵,亚硫酸铵与钡离子结合生成亚硫酸钡沉淀,故A不选;
B.二氧化氮通入溶液中生成硝酸,硝酸氧化二氧化硫反应生成硫酸根离子,与钡离子结合生成硫酸钡沉淀,故B不选;
C.二氧化碳、二氧化硫与氯化钡均不反应,不能生成沉淀,故C选;
D.二氧化硫与硫化氢发生氧化还原反应生成S沉淀,故D不选;
故选C.
(5)Na2S和NaHS的混合溶液显碱性即c(OH-)>c(H+),NaHS以水解为主,则c(HS-)>c(S2-),所以溶液中各离子浓度由大到小的顺序为c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+),所以阴离子的浓度由大到小的顺序为c(HS-)>c(S2-)>c(OH-),故答案为:c(HS-)>c(S2-)>c(OH-);
(6)将pH=1的稀硫酸慢慢加入一定量的BaCl2的溶液中,恰好使Ba2+沉淀完全,发生的是硫酸根和钡离子之间的反应,反应的整个过程中,H+没参加反应,所以前后的H+物质的量没变,导致pH变化的原因是体积的变化,则反应后H+的浓度是0.01mol/L,稀硫酸pH=1,故反应的稀硫酸为10ml,而SO42-的浓度是0.005 mol/L,
故Ba2+的物质的量等于SO42-的物质的量,为0.0005mol,所以Cl-的物质的量是0.001mol,BaCl2溶液为100mL-10mL=90mL,原BaCl2溶液中Cl-的浓度=
| 0.001mol |
| 0.09L |
点评:本题为涉及热化学方程式的书写、溶度积的有关计算、元素化合物知识、离子浓度的比较等知识点,题量大,计算量较大,是对学生心理素质的考验,题目难度较高.

练习册系列答案
相关题目
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A:4HCl+O2
2Cl2+2H2O,可实现氯的循环利用.已知:Ⅰ.反应A中,4mol HCl被氧化,放出116kJ的热量.Ⅱ.拆开1mol o-o键需吸收498kJ的热量,拆开1mol Cl-Cl键需吸.收243kJ的热量.则断开1molH-O键与断开1molH-Cl键所需能量相差为( )
| ||
| 400℃ |
| A、16kJ | B、24kJ |
| C、32kJ | D、48kJ |
下列物质属于纯净物的是( )
| A、氯水 | B、液氯 | C、氨水 | D、盐酸 |
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该无色溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断不正确的是( )
| A、肯定不含I- |
| B、肯定不含Cu2+ |
| C、肯定含有SO32- |
| D、可能含有I- |
某溶液中只可能含有K+、NO3-、SO42-、NH4+、CO32-中的几种(不考虑少量的H+与OH-),取200mL该溶液分成两等份,进行如下实验:一份加入足量烧碱并加热,产生气体在标准状况下为224mL;另一份先加足量盐酸无现象,再加入足量BaCl2得到2.33g固体,则该溶液中( )
| A、可能含有K+ |
| B、肯定含有NO3-、SO42-、NH4+、CO32- |
| C、一定不含有NO3- |
| D、一定含有K+ |