题目内容
9.元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题.| 元素 | 性质或结构信息 |
| A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
| B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
| C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
| D | +2价阳离子的核外电子排布与氖原子相同 |
 .
.(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式2F2+2H2O=4HF+O2
(3)对元素B的单质或化合物描述正确的是bd.
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称)钠.
分析 A的单质制成的高压灯,发出的黄光透雾力强、射程远,且其单质燃烧后生成淡黄色固体,可知A为钠;B的性质为通过分离液态空气获得其单质,原子的最外层电子数是内层电子总数的2.5倍,原子只能有2个电子层,最外层电子数为5,故B为N元素;C的单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构,L层电子数为7,则C为F元素;D元素的+2价阳离子的核外电子排布与氖原子相同,则D为镁.
解答 解:A的单质制成的高压灯,发出的黄光透雾力强、射程远,且其单质燃烧后生成淡黄色固体,可知A为钠;B的性质为通过分离液态空气获得其单质,原子的最外层电子数是内层电子总数的2.5倍,原子只能有2个电子层,最外层电子数为5,故B为N元素;C的单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构,L层电子数为7,则C为F元素;D元素的+2价阳离子的核外电子排布与氖原子相同,则D为镁.
(1)与A(钠)属于同一周期的元素是(写元素符号)Mg,D离子为Mg2+,离子结构示意图为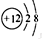 ,
,
故答案为:Mg;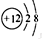 ;
;
(2)氟气能与H2O发生置换反应生成O2,反应的化学方程式:2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(3)对元素B(氮)的单质或化合物描述:
a.B元素的最高正价为+5,故a错误;
b.常温、常压下,氮气难溶于水,故b正确;
c.单质分子中含有14个电子,故c错误;
d.在一定条件下氢气能与氮气反应生成氨气,故d正确,
故选;bd;
(4)同周期从左到右在金属性减弱,A(钠)和D(镁)两元素活泼性较强的是钠,
故答案为:钠.
点评 本题考查位置结构性质的关系,根据性质及结构来推出元素是解答本题的关键,有利于基础知识的巩固.

 科学实验活动册系列答案
科学实验活动册系列答案| A. | MgCl2 | B. | SO2 | C. | I2 | D. | NaOH |
| A. | 钢铁在潮湿的空气中比在干燥空气中更容易生锈 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者 | |
| D. | 已知N2(g)+3H2(g)?2NH3(g),工业上合成氨常在高压下进行 |
| A. | 常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-) | |
| B. | 中和等体积、等pH的盐酸和CH3COOH溶液所消耗的NaOH物质的量相同 | |
| C. | 物质的量浓度相同的下列溶液:Na2CO3、KNO3、NH4Cl pH依次减小 | |
| D. | 将NH4Cl溶液蒸干制备NH4Cl固体 |
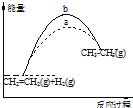
| A. | 图1的曲线说明该反应是放热反应,即CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0 | |
| B. | 化合反应都是放热反应,分解反应都是吸热反应 | |
| C. | 若图1表示有无使用催化剂时的反应进程,则b曲线使用,a曲线没使用 | |
| D. | 图中,若△H=QkJ•mol-1(Q>0),表示正反应活化能比逆反应活化能大QkJ•mol-1 |
| A. | 纤维素与淀粉互为同分异构体 | |
| B. | 糖类、油脂、蛋白质都是高分子化合物,一定条件下均能水解 | |
| C. | 天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点 | |
| D. | 葡萄糖和蔗糖都含有C、H、O三种元素,但不是同系物 |
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题: