题目内容
19. A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,B与A同周期,其s能级电子数比p能级电子数多,C原子的最外层电子数是次外层的3倍,D与B同主族;E的原子序数为29.回答下列问题:(1)五种元素中第一电离能最大的是N(填元素符号),其中D原子价电子排布图为

(2)元素B的简单气态氢化物的沸点高于(填“高于”或“低于”)元素A的简单气态氢化物的沸
点.其主要原因是NH3分子之间存在氢键,A的简单气态氢化物中心原子的杂化轨道类型sp3
(3)BC${\;}_{3}^{-}$的立体构型为平面三角形,与其互为等电子体的分子是SO3(写化学式)
(4)EC在加热条件下容易转化为E2C.从原子结构的角度解释原因Cu2+离子外围电子排布为3d9,而Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定E原子的外围电子排布为3d104s1,E晶体的堆积方式为④(填序号)
①简单立方堆积 ②体心立方堆枳
③六方最密堆积 ④面心立方最密堆积
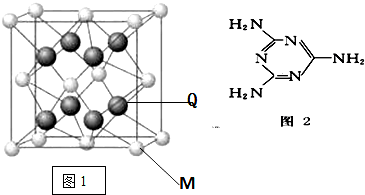
(5)硼与D可形成一种耐磨材料F,其结构与金刚石相似(如图).可由硼的三溴化物和D的三溴化物高温下在氢气的氛围中合成.写出合成F的化学方程式:BBr3+PBr3+3H2 $\frac{\underline{\;高温\;}}{\;}$BP+6HBr,F的晶泡边长为aPm,则该晶体密度的表达式为$\frac{4×42}{{N}_{A}×(a×1{0}^{-10})^{3}}$g.cm-3(含a、NA的式子表示,不必化简).
分析 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古测定生物的死亡年代,则A为碳元素;C原子的最外层电子数是次外层的3倍,原子只能由2个电子层,最外层电子数为6,故C为O元素;B的原子序数介于碳、氧之间,则B为N元素;D与B同主族,则D为P元素;E的原子序数为29,则E为Cu.
(1)非金属性越强第一电离能越大,同周期随原子序数增大,越大第一电离能呈增大趋势,氮元素原子2p能级为半满稳定状态,第一电离能高于同周期相邻元素的;
D为P原子,原子价电子排布式为3s22p3,结合泡利原理、洪特规则画出价电子排布图;
(2)元素B的简单气态氢化物为NH3,元素A的简单气态氢化物为CH4,氨气分子之间形成氢键,沸点高于甲烷的;氨气分子中N原子形成3个N-H键,含有1对孤对电子,杂化轨道数目为4;
(3)计算NO3-中N原子孤电子对数、价层电子对数,确定空间构型;原子数目相等、价电子总数也相等的微粒互为等电子体;
(4)Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定;根据能量最低原理书写Cu原子的外围电子排布式,Cu晶体的堆积方式为面心立方最密堆积;
(5)硼与P可形成一种耐磨材料F,其结构与金刚石相似,则F为BP,可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成,反应还生成HBr,根据原子守恒配平;
计算金刚石晶胞中C原子数目,可以确定晶胞中B、P原子数目,表示出BP晶胞质量,再根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代,则A为碳元素; B与A同周期,其s能级电子数比p能级电子数多,原子核外电子数排布式为1s22s22p3,则B为N元素;C原子的最外层电子数是次外层的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D与B同主族,则D为P元素;E的原子序数为29,则E为Cu.
(1)非金属性越强第一电离能越大,N元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故N元素的第一电离能最大,
D为P元素,原子价电子排布式为3s23p3,原子价电子排布图为 ,
,
故答案为:N; ;
;
(2)元素A、B的简单气态氢化物分别为CH4、NH3,NH3分子之间存在氢键,沸点高于甲烷的,甲烷分子中C原子形成4个C-H将,没有孤对电子,故碳原子采取sp3杂化,
故答案为:高于;NH3分子之间存在氢键;sp3;
(3)NO3-中N原子孤电子对数=$\frac{5+1-2×3}{2}$=0,价层电子对数=3+0=3,立体构型为平面三角形,与其互为等电子体的分子是SO3,
故答案为:平面三角形;SO3;
(4)Cu2+离子外围电子排布为3d9,而Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定,CuO在加热条件下容易转化为Cu2O,
Cu原子的外围电子排布式为:3d104s1,Cu晶体的堆积方式为面心立方最密堆积,
故答案为:Cu2+离子外围电子排布为3d9,而Cu+离子外围电子排布为3d10,为全满稳定状态,Cu2O更稳定;3d104s1;④;
(5)硼与P可形成一种耐磨材料F,其结构与金刚石相似(如图),则F为BP,可由硼的三溴化物和D的三溴化物于高温下在氢气的氛围中合成,合成F的化学方程式:BBr3+PBr3+3H2$\frac{\underline{\;高温\;}}{\;}$BP+6HBr,
金刚石晶胞中C原子数目为4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,则晶胞中B、P原子数目均为4,晶胞质量为4×$\frac{11+31}{{N}_{A}}$g,晶胞边长为a pm,则该晶体密度为4×$\frac{11+31}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{4×42}{{N}_{A}×(a×1{0}^{-10})^{3}}$g•cm-3.
故答案为:BBr3+PBr3+3H2 $\frac{\underline{\;高温\;}}{\;}$BP+6HBr;$\frac{4×42}{{N}_{A}×(a×1{0}^{-10})^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、氢键、空间构型与杂化方式、晶胞计算等,是对物质结构主干知识综合考查,需要学生具备扎实的基础.

| A. | v(H2)=0.3 mol•L-1•min-1 | B. | v(N2)=0.05 mol•L-1•s-1 | ||
| C. | v(N2)=0.2 mol•L-1•min-1 | D. | v(NH3)=0.3 mol•L-1•min-1 |

(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在C的郊区(填标号)
A.有丰富黄铁矿资源的城市 B.风光秀丽的旅游城市
C.消耗硫酸甚多的工业城市 D.人口稠密的文化、商业中心城市
(2)沸腾炉中发生反应的化学方程式为4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$ 2Fe2O3+8SO2,接触室中发生反应的化学方程式是2SO2+O2$?_{△}^{催化剂}$ 2SO3.
(3)在硫酸工业制法中,下列生产操作与说明生产操作的主要原因二者都正确的是D.
A.硫铁矿燃烧前要粉碎,因为大块的黄铁矿不能在空气中反应
B.从沸腾炉出来的气体要净化,因为炉气中的SO2会与杂质反应
C.SO2氧化成SO3要用催化剂,这样可提高SO2的转化率
D.SO3用98.3%的浓硫酸来吸收,目的是为了防止形成酸雾,以提髙SO3吸收效率
(4)表是压强对SO2平衡转化率的影响
| 压强Mpa 转化率% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
(5)某工厂用500t含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是376.32tt.
| A. | 由铝土矿冶铝:铝土矿$→_{Na_{3}AlF_{6}}^{电解}$Al | |
| B. | 制硫酸:硫铁矿$→_{空气}^{高温}$SO2$\stackrel{H_{2}O}{→}$H2SO3$\stackrel{O_{2}}{→}$H2SO4 | |
| C. | 由NaCl制漂白粉:NaCl(aq)$\stackrel{电解}{→}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| D. | 合成氨:NH4Cl和Ca(OH)2固体$\stackrel{△}{→}$NH3$\stackrel{碱石灰}{→}$纯净干燥的氨气 |
| A. | 1和17 | B. | 12和9 | C. | 11和16 | D. | 12和8 |
| A. | 甲苯 | B. | 聚乙烯 | C. | SO2 | D. | 乙炔 |
| A. | Mg在CO2中燃烧生成MgO和C,是放热反应 | |
| B. | 工业上通过电解MgCl2溶液制取金属镁 | |
| C. | Mg和稀硫酸反应时,滴加少量硫酸铜溶液,能加快反应速率 | |
| D. | 镁可以用来制造信号弹和焰火,MgO可以作耐高温材料 |
| 元素 | 性质或结构信息 |
| A | 单质制成的高压灯,发出的黄光透雾力强、射程远.且其单质燃烧后生成淡黄色固体 |
| B | 工业上通过分离液态空气获得其单质.原子的最外层电子数是内层电子总数的2.5倍 |
| C | 单质是双原子分子,常温、常压下是淡黄绿色气体,原子的L层再增加一个电子即达到稳定结构 |
| D | +2价阳离子的核外电子排布与氖原子相同 |
 .
.(2)已知C的单质能与H2O发生置换反应生成O2,写出C单质与水反应的化学方程式2F2+2H2O=4HF+O2
(3)对元素B的单质或化合物描述正确的是bd.
a.B元素的最高正价为+6 b.常温、常压下单质难溶于水
c.单质分子中含有18个电子 d.在一定条件下氢气能与单质B反应
(4)A和D两元素活泼性较强的是(写元素名称)钠.