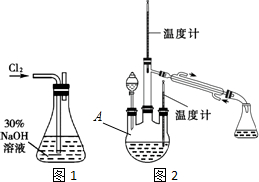
题目内容
13. 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸亚铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO;
假设二:全部是Fe3O4;
假设三:是FeO和Fe3O4的混合物.
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸或稀硫酸, 在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立, 溶液变成红色,则假设一不成立 |
分析 (1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到CO2生成.说明草酸亚铁被氧化为铁离子、二氧化碳气体,草酸亚铁具有还原性,依据电子守恒计算得到消耗的高锰酸钾物质的量;
(2)草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体可能为氧化亚铁或四氧化三铁,分析判断;
(3)【定性研究】氧化亚铁溶解于盐酸生成氯化亚铁溶液,加入KSCN溶液,若溶液不变红证明假设一正确;
【定量研究】根据图中提供的信息,通过计算可以判断反应的化学方程式和物质的化学式.
解答 解:(1)盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到有二氧化碳气体生成,草酸亚铁被氧化为铁离子和二氧化碳,说明草酸亚铁具有还原性;根据氧化还原反应得失电子数相等、原子守恒、电荷守恒可写出化学方程式,化学方程式为5Fe2++5C2O42-+3MnO4-+24H+=5Fe3++10 CO2↑+3Mn2++12H2O,反应中消耗1 mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol,
故答案为:还原性;0.6;
(2)草酸亚铁加热分解生成几种氧化物,残留物为黑色固体,故可能为FeO和Fe3O4中的一种或几种,故假设二为Fe3O4,假设三为FeO和Fe3O4,
故答案为:全部是Fe3O4;是FeO和Fe3O4的混合物;
(3)【定性研究】为了验证假设一成不成立,由于假设一为只有氧化亚铁,所以只需要检验残余固体中是否含有三价铁离子即可,操作为取少量黑色固体,加适量盐酸溶解后,再向溶液中加几滴KSCN溶液,看是否出现血红色,如果不出现血红色则假设一成立,出现血红色则假设一不成立,
故答案为:
| 实验步骤(不要求写出具体操作程) | 预期实验现象和结论 |
| 加入适量稀盐酸或稀硫酸,在溶液中加入硫氰化钾溶液 | 溶液不变红色,则假设一成立,溶液变成红色,则假设一不成立 |
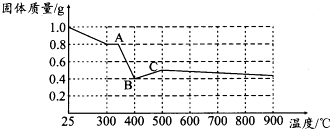
【定量研究】从图象上可以看出加热分解的FeC2O4•2H2O的质量为1g,从开始到A点样品的质量变为0.8g,减少了0.2g,又经计算草酸晶体中水的质量分数为20%,可得到该温度范围内发生的反应是:草酸亚铁晶体加热失去结晶水,A点的温度为300℃;从A到B质量从0.8g降低到0.4g,根据(2)中的猜想和计算可得:1g草酸亚铁晶体分解生成的物质如果为氧化亚铁的话,刚好能够得到0.4g氧化亚铁;从B到C剩余固体的质量又呈现增大的趋势,此时应该是400℃以前得到的氧化亚铁被氧化为四氧化三铁了;经上述分析,400℃时一定反应生成氧化亚铁和二氧化碳,铁元素化合价未发生变化,碳的化合价升高,发生了氧化反应,氧化反应和还原反应应该是同时发生的,所以碳一定还有化合价降低生成+2价的CO,反应的化学返程式为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑,
故答案为:FeC2O4•2H2O═FeO+CO2↑+CO↑+2H2O↑.
点评 本题考查了探究物质组成与含量的方法,题目难度中等,明确实验目的、实验原理为解答关键,试题知识点较多、综合性较强,试题侧重考查学生的分析、理解能力及化学实验能力.

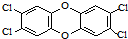 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
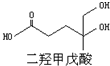 我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
我国科学家屠呦呦因为发现青蒿素而获得2015年诺贝尔生理和医学奖.已知二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )| A. | 二羟甲戊酸的分子式为C6H10O4 | |
| B. | 能发生加成反应,不能发生取代反应 | |
| C. | 在铜的催化下与氧气反应的产物能发生银镜反应 | |
| D. | 1mol该有机物可以与足量金属钠反应产生33.6L H2 |
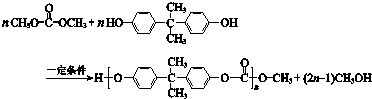
| A. | PC含有酯基 | |
| B. | 合成PC的反应为缩聚反应 | |
| C. | 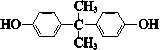 与 与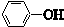 互为同系物 互为同系物 | |
| D. | 1 mol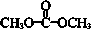 最多能与2 mol NaOH完全反应 最多能与2 mol NaOH完全反应 |
| 选项 | 实验过程 | 现象 | 解释或结论 |
| A | 向浑浊的苯酚溶液中加入Na2CO3饱和溶液 | 溶液变澄清 | 酸性:苯酚>碳酸 |
| B | 向稀苯酚溶液中加入少量稀溴水 | 未见白色沉淀 | 苯酚不与溴反应 |
| C | 乙醇与重铬酸钾(K2Cr2O7)溶液混合 | 橙色溶液变为绿色 | 证明:乙醇具有还原性 |
| D | 将乙醇和3mol•L-1的硫酸按体积之比1:3混合共热至170℃,产生的气体通入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | 乙醇发生消去反应 |
| A. | A | B. | B | C. | C | D. | D |
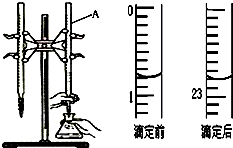 如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:
如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:(1)仪器A的名称是酸式滴定管;
(2)盐酸的体积读数:
滴定前读数为0.80mL,
滴定后读数为22.80mL.
(3)某实验小组同学的三次实验的实验数据如下表所示. 根据表中数据计算出的待测NaOH溶液的平均浓度是0.1100 mol/L.(保留四位有效数字)
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数(mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
(5)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①若滴定前锥形瓶未用待测液润洗,对测定结果的影响是无影响;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.偏高
③标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是偏低.
| A. | 分子式为C5H12的化合物,其一氯代物种类(不考虑立体异构)不可能是2种 | |
| B. | 棉花、羊毛、蚕丝均属于天然纤维 | |
| C. | 乙二酸二乙酯、乙二酸乙二酯、二乙酸乙二酯它们互为同分异构体 | |
| D. | 石油裂化、油脂皂化和煤的干馏都是化学变化,而石油的分馏和蛋白质的盐析都是物理变化 |