题目内容
18.下列实验操作能达到相应实验目的是( )| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 向2mL 1mol•L-1NaOH溶液中先加入3滴1mol•L-1 FeCl3,再加入3滴1mol•L-1MgCl2溶液 | 证明K[Mg(OH)2]>K[Fe(OH)3] |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴NaClO的84消毒液,观察红色褪色的快慢 | 证明溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫不能漂白酸碱指示剂;
B.氢氧化钠过量,不能证明溶度积大小;
C.比较催化剂对反应速率的影响,应在相同浓度下完成;
D.酸性条件下,HClO浓度较大,氧化性较强.
解答 解:A.将二氧化硫气体通入紫色石蕊试液中,溶液变为红色,只能说明二氧化硫为酸性氧化物,故A错误;
B.氢氧化钠过量,氢氧化铁、氢氧化镁都存在,不能证明溶度积大小,故B错误;
C.比较催化剂对反应速率的影响,应在相同浓度下完成,否则不能排除浓度的影响,故C错误;
D.酸性条件下,HClO浓度较大,氧化性较强,品红褪色较快,故D正确.
故选D.
点评 本题考查实验方案的评价,为高考常见题型,涉及性质的检验、比较等,侧重于学生的分析能力和实验能力的考查,注意把握实验的严密性和可行性的评价,题目难度不大.

练习册系列答案
相关题目
8.有关苯的结构和性质,下列说法正确的是( )
| A. | 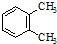 与 与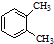 是同分异构体 是同分异构体 | |
| B. | 苯在空气中不易燃烧完全,燃烧时冒浓烟 | |
| C. | 煤干馏得到的煤焦油可以分离出苯,苯是无色无味的液态烃 | |
| D. | 向2mL苯中加入1mL酸性高锰酸钾溶液,震荡后静置,可观察到液体分层,上层呈紫红色 |
6.化学与生产、生活 密切相关,背景材料:
①浙大研制的石墨烯弹性气凝胶(又名碳海锦)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用属铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
①浙大研制的石墨烯弹性气凝胶(又名碳海锦)入选2013年度世界最轻固体材料;
②2014年11月上旬北京APEC峰会期间,政府重拳整治雾霾,蓝天重现;
③用属铂丝或无锈铁丝可用来进行钠、钾、铜、钡、锶等的焰色反应
④瑞典皇家理工学院(KTH)的研究人员已经成功地构建出了一种能使水快速分解的分子催化剂.
下列说法不正确的是( )
| A. | 石墨烯弹性气凝胶可用作处理海上原油泄漏的吸油材料 | |
| B. | 压减燃煤、严格控车、调整产业是治理雾霾有效措施 | |
| C. | 绚丽缤纷的烟花中添加了含钾、钠、铁、铜等金属化合物 | |
| D. | 该分子催化剂可将一次能源太阳能直接转化成二次能源 |
3.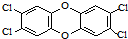 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
( )
 二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是
二噁英是一类芳香族化合物的多氯代衍生物的总称,结构稳定,难以被自然分解,是公认的最危险的致癌物质之一.如图是其中一种的结构.下列说法中不正确的是( )
| A. | 它能发生还原反应 | B. | 它能燃烧 | ||
| C. | 它的一溴取代物只有一种 | D. | 此分子中共平面的原子最多有18个 |
7.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验溴乙烷是否发生消去反应 | 溴乙烷与NaOH乙醇溶液共热,将产物通入到Br2的CC14溶液中,观察溶液是否褪色 |
| B | 验证电离H+的能力 HClO>HCO3- | 向NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 验证H2O与NH3的配位能力强弱 | 向CuSO4溶液中逐滴加入过量NH3•H2O,观察蓝色溶液是否最终转化为深蓝色溶液 |
| D | 检验Na2O2的强氧化性 | 向FeSO4溶液中加入少量Na2O2粉末,观察是否有红褐色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |


 ,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应.
,D分子中含氧官能团的名称为羧基,反应B→C的反应类型为取代反应. ),下列有关G的叙述正确的是B.(填选项)
),下列有关G的叙述正确的是B.(填选项)