题目内容
写出下列燃烧热的热化学方程式.
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量.写出CH4的燃烧热化学方程式 .
(2)在标准状况下,44.8LH2完全燃烧生成液态水放出571.6kJ的热量,求在此条件下H2的燃烧热化学方程式
(3)已知碳的燃烧热为393.5kJ/mol,写出碳的燃烧热化学方程式 .
(1)0.5molCH4完全燃烧生成CO2和液态水时,放出445kJ的热量.写出CH4的燃烧热化学方程式
(2)在标准状况下,44.8LH2完全燃烧生成液态水放出571.6kJ的热量,求在此条件下H2的燃烧热化学方程式
(3)已知碳的燃烧热为393.5kJ/mol,写出碳的燃烧热化学方程式
考点:热化学方程式
专题:化学反应中的能量变化
分析:(1)依据热化学方程式书写方法,标注物质聚集状态和反应焓变写出热化学方程式;
(2)标准状况下22.4L氢气物质的量为1mol,燃烧生成液态水时放出285.8KJ的热量,则2mol氢气燃烧生成液态水放热571.6KJ,依据热化学方程式书写方法写出;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写;
(2)标准状况下22.4L氢气物质的量为1mol,燃烧生成液态水时放出285.8KJ的热量,则2mol氢气燃烧生成液态水放热571.6KJ,依据热化学方程式书写方法写出;
(3)依据燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写;
解答:
解:(1)0.5mol CH4完全燃烧生成CO2和液态H2O时,放出445kJ热量,1mol甲烷燃烧生成二氧化碳和液态水放热890kJ,反应的热化学方程式为:
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
(2)标准状况下44.8L氢气物质的量为2mol,燃烧生成液态水时放出571.6KJ的热量,反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△=-571.6KJ/mol,则氢气的燃烧热为:H2(g)+
O2(g)=H2O(l)△=-285.8KJ/mol;
故答案为:H2(g)+
O2(g)=H2O(l)△=-285.8KJ/mol;
(3)已知碳的燃烧热为393.5kJ/mol,碳的燃烧热化学方程式为:C(s)+
O2(g)=CO2(g)△H=-393.5kJ/mol;
故答案为:C(s)+
O2(g)=CO2(g)△H=-393.5kJ/mol;
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
故答案为:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890kJ/mol;
(2)标准状况下44.8L氢气物质的量为2mol,燃烧生成液态水时放出571.6KJ的热量,反应的热化学方程式为:2H2(g)+O2(g)=2H2O(l)△=-571.6KJ/mol,则氢气的燃烧热为:H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(3)已知碳的燃烧热为393.5kJ/mol,碳的燃烧热化学方程式为:C(s)+
| 1 |
| 2 |
故答案为:C(s)+
| 1 |
| 2 |
点评:本题考查了热化学方程式的书写方法,注意物质状态的标注和焓变的计算,题目较简单.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
下列有关物质的性质及应用说法正确的是( )
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
常见金属R与硝酸银溶液反应的化学方程式为R+3AgNO3═3Ag+R(NO3)3,有关该反应的说法正确的是( )
| A、反应后溶液质量一定增加 |
| B、该金属可能是铁 |
| C、R的活泼性比Ag弱 |
| D、R表面有固体析出 |
已知化学能与其他形式的能可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是( )
A、CH4+2O2
| ||||
B、CaCO3
| ||||
C、2H2O
| ||||
D、Pb+PbO2+2H2SO4
|
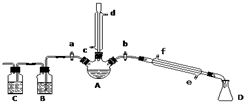 某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答:
某兴趣小组在实验室用加热乙醇、浓H2SO4、溴化钠和少量水的混合物来制备溴乙烷,并检验反应的部分副产物.设计了如图装置,其中夹持仪器、加热仪器及冷却水管没有画出.请根据实验步骤回答: