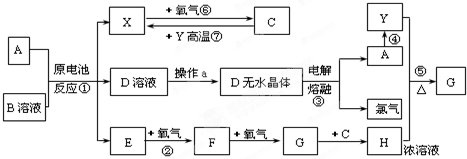
题目内容
右图是用0.1000mol/L的NaOH溶液滴定20.00mL未知浓度盐酸(酚酞作指示剂)的滴定曲线.下列说法正确的是( )
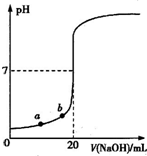

| A、水电离出的氢离子浓度:a>b |
| B、盐酸的物质的量浓度为0.0100mol?L-1 |
| C、指示剂变色时,说明盐酸与NaOH恰好完全反应 |
| D、当滴加NaOH溶液10.00mL时,该混合液的pH=1+lg3 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.盐酸的浓度越大,水的电离程度越小;
B.根据酸碱中和时二者物质的量相等计算;
C.指示剂为酚酞,滴定终点呈碱性;
D.当滴加NaOH溶液10.00mL时,计算溶液中氢离子浓度,进而可确定pH.
B.根据酸碱中和时二者物质的量相等计算;
C.指示剂为酚酞,滴定终点呈碱性;
D.当滴加NaOH溶液10.00mL时,计算溶液中氢离子浓度,进而可确定pH.
解答:
解:A.由图象可知,a点盐酸浓度较大,pH较小,则水的电离程度越小,故A错误;
B.加入NaOH溶液20mL时,溶液呈中性,则0.1000mol/L×20×10-3L=20×10-3L×c,c=0.1000mol/L,故B错误;
C.指示剂为酚酞,变色范围为8.1~10,滴定终点呈碱性,指示剂变色时,氢氧化钠稍过量,故C错误;
D.当滴加NaOH溶液10.00mL时,剩余c(H+)=
=
×0.1mol/L,pH=1+lg3,故D正确.
故选D.
B.加入NaOH溶液20mL时,溶液呈中性,则0.1000mol/L×20×10-3L=20×10-3L×c,c=0.1000mol/L,故B错误;
C.指示剂为酚酞,变色范围为8.1~10,滴定终点呈碱性,指示剂变色时,氢氧化钠稍过量,故C错误;
D.当滴加NaOH溶液10.00mL时,剩余c(H+)=
| 20×10-3L×0.1mol/L-10×10-3L×0.1mol/L |
| 30×10-3L |
| 1 |
| 3 |
故选D.
点评:本题考查酸碱混合的定性判断和计算,为高频考点,侧重于学生的分析能力和计算能力的考查,主要把握相关计算公式的运用以及水的电离特点,难度不大.

练习册系列答案
相关题目
1911年,根据粒子射线实验的基本事实,提出了原子结构的行星模型的伟大科学家是( )
| A、门捷列夫 | B、道尔顿 |
| C、卢瑟福 | D、汤姆孙 |
下列做法不正确的是( )
| A、为了使一些肉制食品颜色更鲜红,可多加一些亚硝酸钠 |
| B、为了使婴儿对食品有浓厚兴趣,我们可以在婴儿食品中加少量着色剂 |
| C、食盐加碘是防止人体缺碘而加的营养强化剂,能预防地方性甲状腺肿 |
| D、脂肪中必需脂肪酸的含量越高,其营养价值越高 |