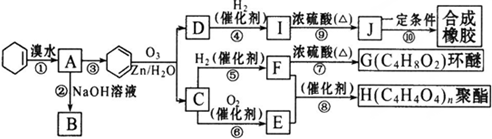
题目内容
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体.
(1)写出以下元素的名称:B ;C .
(2)用化学方程式表示C2D的形成过程: .
(3)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为 .此实验中常加入一种黑色粉未物质,其作用是 .
(1)写出以下元素的名称:B
(2)用化学方程式表示C2D的形成过程:
(3)实验室常用A、B两元素所形成的原子个数为1:1的化合物来制备一种常见气体,其化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D是四种短周期元素,它们的原子序数依次增大,A元素的原子半径是所有主族元素中原子半径最小,则A为氢元素;A、C及B、D分别是同主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍,则B、D在二、三周期,故C处于第三周期,则C为钠元素;B、D分别是同主族元素,B、D两元素的原子核中质子数之和为2(1+11)=24,故B为氧元素,D为硫元素;其中四种元素所形成的单质中A、B单质是气体,C、D单质是固体,符合要求,据此进行解答.
解答:
解:A、B、C、D为短周期元素,其原子序数依次增大,A元素的原子半径是所有主族元素中原子半径最小,则A为氢元素;A、C及B、D分别是同主族元素,B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍,则B、D在第2、3周期,故C处于第三周期,则C为Na元素;B、D分别是同主族元素,B、D两元素的原子核中质子数之和为2(1+11)=24,故B为O元素,D为S元素;其中四种元素所形成的单质中A、B单质是气体,C、D单质是固体,符合题意,故A为氢元素,B为氧元素,C为钠元素,D为硫元素,
(1)由上述分析可知,B为O元素,名称为氧;C为Na元素,名称为钠,
故答案为:氧;钠;
(2)C2D为Na2S,可以用金属钠与硫单质反应生成,反应的化学方程式为:2Na+S
Na2S,
故答案为:2Na+S
Na2S;
(3)A为氢元素,B为氧元素,两元素所形成的原子个数为1:1的化合物为H2O2,实验室常用H2O2气体O2,反应的化学方程式为:2H2O2
2H2O+O2↑,黑色粉未为二氧化锰,其作用是催化剂,
故答案为:2H2O2
2H2O+O2↑;催化剂.
(1)由上述分析可知,B为O元素,名称为氧;C为Na元素,名称为钠,
故答案为:氧;钠;
(2)C2D为Na2S,可以用金属钠与硫单质反应生成,反应的化学方程式为:2Na+S
| ||
故答案为:2Na+S
| ||
(3)A为氢元素,B为氧元素,两元素所形成的原子个数为1:1的化合物为H2O2,实验室常用H2O2气体O2,反应的化学方程式为:2H2O2
| ||
故答案为:2H2O2
| ||
点评:本题以元素推断为载体,考查学生利用原子的结构来推断元素、常用化学用语等知识,题目难度中等,利用A、C与B、D的质子数之和关系分析是解答本题的难点,注意掌握元素位置、结构与性质的关系.

练习册系列答案
相关题目
下列叙述不正确的是( )
| A、标准状况下,1 mol任何气体体积均约为22.4 L |
| B、同温、同压下,体积相同的两种气体单质具有相同的分子数目 |
| C、将73 g HCl溶于1 L水中配成溶液,所得溶液物质的量浓度是2 mol?L-1 |
| D、含NA个Na+的Na2O溶解于水配成1 L溶液,Na+的物质的量浓度为1 mol?L-1 |
在密闭容器中进行如下反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol/L、0.3 mol/L、0.2 mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )
| A、Z为0.3mol/L |
| B、Y2为0.4mol/L |
| C、X2为0.2mol/L |
| D、Z为0.4mol/L |