题目内容
X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,核电荷数按照Y、Z、X、W的顺序增大.已知Y与Z的原子次外层的电子数均为2,W、X的原子次外层的电子数均为8.
(1)写出各元素的名称:
X ,Y ,Z ,W .
(2)写出它们在元素周期表中的位置:
X ,Y ,Z ,W .
(3)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式: .
(4)按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式: , , , .
(1)写出各元素的名称:
X
(2)写出它们在元素周期表中的位置:
X
(3)写出X的最高价氧化物与Z的最高价氧化物对应水化物反应的化学方程式:
(4)按碱性减弱、酸性增强的顺序写出各元素最高价氧化物对应水化物的分子式:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族.核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,说明Y、Z含有两个电子层,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,以此解答该题.
解答:
解:(1)X、Y、Z、W为短周期的元素,且其最高正价依次为+1、+4、+5、+7,则X、Y、Z、W分别位于第ⅠA族、ⅣA族、ⅤA族、ⅦA族.核电荷数按照Y、Z、X、W的顺序增大,由于Y与Z的原子次外层的电子数为2,则Y为C元素、Z为N元素;W、X原子次外层电子数为8,则W为Cl元素、X为Na元素,
所以X为Na元素,元素名称为钠;Y为C元素,元素名称为碳;Z为N元素,元素名称为氮;W为Cl元素,元素名称为氯,
故答案为:钠;碳;氮;氯.
(2)X为Na元素,质子数为11,核外电子数为11,有3个电子层,最外层1个电子,原子结构示意图为: ,则X位于周期表中第三周期ⅠA族;
,则X位于周期表中第三周期ⅠA族;
Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为 ,则Y位于周期表中第二周期ⅣA族;
,则Y位于周期表中第二周期ⅣA族;
Z为N元素,质子数为7,核外电子数为7,有2个电子层,最外层5个电子,原子结构示意图为 ,则Z位于周期表中第二周期ⅤA族;
,则Z位于周期表中第二周期ⅤA族;
W为Cl元素,质子数为17,核外电子数为17,有3个电子层,最外层7个电子,原子结构示意图为 ,则W位于周期表中第三周期ⅦA族,
,则W位于周期表中第三周期ⅦA族,
故答案为:第三周期ⅠA族;第二周期ⅣA族;第二周期ⅤA族;第三周期ⅦA族;
(3)X的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HNO3,二者反应生成硝酸钠和水,反应的化学方程式为:NaOH+HNO3=NaNO3+H2O,
故答案为:NaOH+HNO3=NaNO3+H2O;
(4)X的最高价氧化物对应的水化物为NaOH,Y的最高价氧化物对应的水化物为H2CO3,Z的最高价氧化物对应的水化物为HNO3,W的最高价氧化物对应的水化物为HClO4,
金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为:NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
所以X为Na元素,元素名称为钠;Y为C元素,元素名称为碳;Z为N元素,元素名称为氮;W为Cl元素,元素名称为氯,
故答案为:钠;碳;氮;氯.
(2)X为Na元素,质子数为11,核外电子数为11,有3个电子层,最外层1个电子,原子结构示意图为:
 ,则X位于周期表中第三周期ⅠA族;
,则X位于周期表中第三周期ⅠA族;Y为C元素,质子数为6,核外电子数为6,有2个电子层,最外层4个电子,原子结构示意图为
 ,则Y位于周期表中第二周期ⅣA族;
,则Y位于周期表中第二周期ⅣA族;Z为N元素,质子数为7,核外电子数为7,有2个电子层,最外层5个电子,原子结构示意图为
 ,则Z位于周期表中第二周期ⅤA族;
,则Z位于周期表中第二周期ⅤA族;W为Cl元素,质子数为17,核外电子数为17,有3个电子层,最外层7个电子,原子结构示意图为
 ,则W位于周期表中第三周期ⅦA族,
,则W位于周期表中第三周期ⅦA族,故答案为:第三周期ⅠA族;第二周期ⅣA族;第二周期ⅤA族;第三周期ⅦA族;
(3)X的最高价氧化物对应的水化物为NaOH,Z的最高价氧化物对应的水化物为HNO3,二者反应生成硝酸钠和水,反应的化学方程式为:NaOH+HNO3=NaNO3+H2O,
故答案为:NaOH+HNO3=NaNO3+H2O;
(4)X的最高价氧化物对应的水化物为NaOH,Y的最高价氧化物对应的水化物为H2CO3,Z的最高价氧化物对应的水化物为HNO3,W的最高价氧化物对应的水化物为HClO4,
金属性越强,最高价氧化物对应的水化物碱性越强,非金属性越强,最高价氧化物对应的水化物酸性越强,所以碱性减弱、酸性增强的顺序为:NaOH、H2CO3、HNO3、HClO4,
故答案为:NaOH;H2CO3;HNO3;HClO4.
点评:本题考查元素周期表和周期律知识,题目难度中等,根据题干信息及所学知识正确推断元素的种类为解答该题的关键,注意掌握元素周期表结构、元素周期律的递变规律,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
下列化学用语和描述均正确的是( )
A、结构示意图为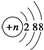 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为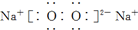 和 和 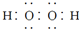 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
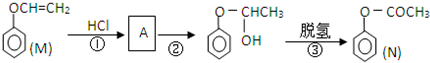
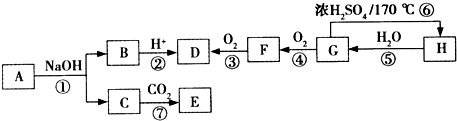
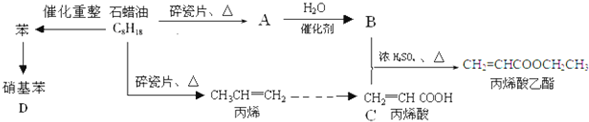
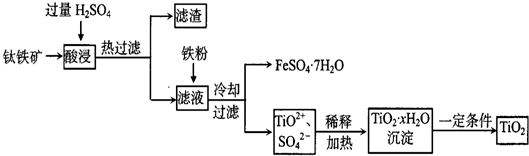
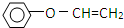 )是一种重要的化工原料,请回答下列问题:
)是一种重要的化工原料,请回答下列问题: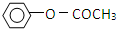 )的流程如下(条件略)
)的流程如下(条件略)