题目内容
下列叙述不正确的是( )
| A、标准状况下,1 mol任何气体体积均约为22.4 L |
| B、同温、同压下,体积相同的两种气体单质具有相同的分子数目 |
| C、将73 g HCl溶于1 L水中配成溶液,所得溶液物质的量浓度是2 mol?L-1 |
| D、含NA个Na+的Na2O溶解于水配成1 L溶液,Na+的物质的量浓度为1 mol?L-1 |
考点:阿伏加德罗定律及推论,物质的量浓度的相关计算
专题:阿伏加德罗常数和阿伏加德罗定律,物质的量浓度和溶解度专题
分析:A.标况下,气体摩尔体积是22.4L/mol,根据V=nVm知,气体体积与物质的量成正比;
B.同温同压下,气体摩尔体积相等,根据N=nNA=
NA计算其分子数之比;
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
计算其物质的量浓度;
D.含NA个Na+的Na2O的物质的量=
=0.5mol,溶解于水配成1 L溶液,根据C=
计算其物质的量浓度.
B.同温同压下,气体摩尔体积相等,根据N=nNA=
| V |
| Vm |
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
| n |
| V |
D.含NA个Na+的Na2O的物质的量=
| ||
| NA/mol |
| n |
| V |
解答:
解:A.标况下,气体摩尔体积是22.4L/mol,根据V=nVm知,气体体积与物质的量成正比,所以1 mol任何气体体积均约为22.4 L,故A正确;
B.同温同压下,气体摩尔体积相等,根据N=nNA=
NA知,相同体积时其分子个数相等,故B正确;
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
知,其物质的量浓度小于2mol/L,故C错误;
D.含NA个Na+的Na2O的物质的量=
=0.5mol,溶解于水配成1 L溶液,C=
=
=0.5mol/L,故D正确;
故选C.
B.同温同压下,气体摩尔体积相等,根据N=nNA=
| V |
| Vm |
C.73gHCl的物质的量是2mol,溶于1L水时,溶液的体积大于1L,根据C=
| n |
| V |
D.含NA个Na+的Na2O的物质的量=
| ||
| NA/mol |
| n |
| V |
| 0.5mol |
| 1L |
故选C.
点评:本题考查阿伏伽德罗定律及其推论,明确物质的量公式中各个物理量的关系是解本题关键,易错选项是C,注意物质的量浓度公式中V指溶液体积而不是溶剂体积,为易错点.

练习册系列答案
相关题目
120℃、101kPa,甲烷(CH4)和过量的O2的混合物,用电火花引燃(CH4+2O2=CO2+2H2O)后,恢复到原来的温度和压强,测得反应后气体密度为相同条件下H2密度的15倍,则原混合气体中甲烷和氧气的体积比为( )
| A、9:1 | B、1:9 |
| C、1:7 | D、7:1 |
下列离子方程式正确的是( )
| A、已知H2SO3的Ka1大于HClO的Ka NaClO+H2O+SO2═Na2SO3+HClO | ||||
| B、碳酸氢钠水解 HCO3-+H2O?H3O++CO32- | ||||
C、实验室制备氢氧化铁胶体 Fe3++3H2O
| ||||
| D、向NaHSO4溶液中加入Ba(OH)2溶液至刚好呈中性 H++SO42-+Ba2++OH-═BaSO4↓+H2O |
下列各图所表示的反应属于放出热量的是( )
A、 |
B、 |
C、 |
D、 |
下列化学用语和描述均正确的是( )
A、结构示意图为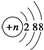 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | ||
B、球棍模型为: 的分子可发生加成反应 的分子可发生加成反应 | ||
C、符号为
| ||
D、电子式分别为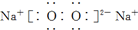 和 和 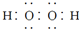 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |