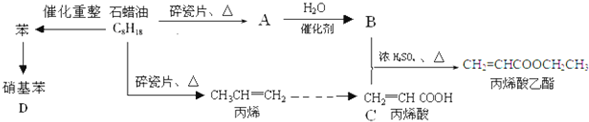
题目内容
某同学从网络上了解到菠菜中富含可溶性的两类正盐:草酸盐和碳酸盐.该同学欲用实验验证这一事实并检测其中草酸盐的含量.查阅资料得知草酸(H2C2O4)是一种二元有机弱酸,具有较强的还原性;草酸钙(CaC2O4)不溶于水能溶于稀硫酸.请回答下列问题:
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A.研磨菠菜使用的实验仪器的名称为 .
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论.
(3)欲准确测定菠菜中草酸盐的含量
①操作:取m g菠菜样品,将其中草酸盐全部转化为CaC2O4沉淀分离出来置于烧杯中,用过量的稀硫酸完全溶解后,溶液转入 中并加水配制成250mL溶液.每次移取25.00mL该溶液于锥形瓶中,用0.0100mol?L-1 KMnO4标准溶液滴定,平均消耗标准溶液V mL.KMnO4滴定实验时发生的离子方程式为 .
②计算:菠菜中草酸盐(以C2O42-计算)的质量分数为(可以只列式不化简) .
③误差分析:下列操作会使测定结果偏高的是 .
A.配制溶液时未洗涤烧杯和玻璃棒就加水定容
B.锥形瓶未干燥就加入待测液进行滴定
C.未用标准液润洗就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失
E.滴定后俯视读数.
(1)该学生将菠菜研磨成粉末、热水浸泡、过滤得到澄清溶液A.研磨菠菜使用的实验仪器的名称为
(2)设计实验方案验证菠菜中含有草酸盐和碳酸盐,补充完成预期现象和结论.
| 实验步骤 | 预期现象和结论 |
| 步骤1:调节溶液A至弱碱性,滴加足量CaCl2溶液. | ①出现白色沉淀,说明菠菜中 |
| 步骤2:取步骤1的沉淀于试管中,加入足量的稀硫酸,沉淀完全溶解,并将产生的无色无味的气体通入澄清石灰水中. | ② |
| 步骤3:向步骤2得到的溶液中滴加几滴高锰酸钾溶液. | ③ |
①操作:取m g菠菜样品,将其中草酸盐全部转化为CaC2O4沉淀分离出来置于烧杯中,用过量的稀硫酸完全溶解后,溶液转入
②计算:菠菜中草酸盐(以C2O42-计算)的质量分数为(可以只列式不化简)
③误差分析:下列操作会使测定结果偏高的是
A.配制溶液时未洗涤烧杯和玻璃棒就加水定容
B.锥形瓶未干燥就加入待测液进行滴定
C.未用标准液润洗就加入标准液开始滴定
D.滴定前尖嘴处有气泡滴定后气泡消失
E.滴定后俯视读数.
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)固体研磨用到的仪器为研钵,研磨菠菜使用的实验仪器的名称为研钵;
(2)草酸钙和碳酸钙均为不溶于水的白色固体,步骤1中出现白色沉淀,说明菠菜中至少含有C2O42-、CO32-中的一种或两种皆有;步骤2的目的是验证菠菜中含有碳酸盐,选用稀盐酸溶解沉淀,方法是:加入足量1 mol?L-1 HCl,将产生的气体通入足量澄清石灰水中,现象是沉淀溶解,澄清石灰水变浑浊,说明菠菜中含有碳酸盐;步骤3操作目的是验证草酸盐的存在,利用草酸盐具有还原性,方法是;向步骤2得到的溶液中滴加几滴0.01 mol?L-1 KMnO4,现象是溶液紫红色褪去,说明菠菜中含有草酸盐;
(3)①配制250mL溶液应选用250mL容量瓶;KMnO4标准溶液与C2O42-反应生成+2价锰离子、二氧化碳和水;
②计算:根据反应方程式得关系式:5C2O42-~2KMnO4,代入题给数据计算;
③误差分析:A.配制溶液时未洗涤烧杯和玻璃棒就加水定容,高锰酸钾溶液的体积偏小,测定结果偏低;
B.锥形瓶未干燥就加入待测液进行滴定,对测定结果无影响;
C.未用标准液润洗就加入标准液开始滴定,高锰酸钾溶液的体积偏大,测定结果偏高;
D.滴定前尖嘴处有气泡滴定后气泡消失,高锰酸钾溶液的体积偏大,测定结果偏高;
E.滴定后俯视读数,高锰酸钾溶液的体积偏小,测定结果偏低.
(2)草酸钙和碳酸钙均为不溶于水的白色固体,步骤1中出现白色沉淀,说明菠菜中至少含有C2O42-、CO32-中的一种或两种皆有;步骤2的目的是验证菠菜中含有碳酸盐,选用稀盐酸溶解沉淀,方法是:加入足量1 mol?L-1 HCl,将产生的气体通入足量澄清石灰水中,现象是沉淀溶解,澄清石灰水变浑浊,说明菠菜中含有碳酸盐;步骤3操作目的是验证草酸盐的存在,利用草酸盐具有还原性,方法是;向步骤2得到的溶液中滴加几滴0.01 mol?L-1 KMnO4,现象是溶液紫红色褪去,说明菠菜中含有草酸盐;
(3)①配制250mL溶液应选用250mL容量瓶;KMnO4标准溶液与C2O42-反应生成+2价锰离子、二氧化碳和水;
②计算:根据反应方程式得关系式:5C2O42-~2KMnO4,代入题给数据计算;
③误差分析:A.配制溶液时未洗涤烧杯和玻璃棒就加水定容,高锰酸钾溶液的体积偏小,测定结果偏低;
B.锥形瓶未干燥就加入待测液进行滴定,对测定结果无影响;
C.未用标准液润洗就加入标准液开始滴定,高锰酸钾溶液的体积偏大,测定结果偏高;
D.滴定前尖嘴处有气泡滴定后气泡消失,高锰酸钾溶液的体积偏大,测定结果偏高;
E.滴定后俯视读数,高锰酸钾溶液的体积偏小,测定结果偏低.
解答:
解:(1)固体研磨用到的仪器为研钵,研磨菠菜使用的实验仪器的名称为研钵;故答案为:研钵;
(2)草酸钙和碳酸钙均为不溶于水的白色固体,步骤1中出现白色沉淀,说明菠菜中至少含有C2O42-、CO32-中的一种或两种皆有;步骤2的目的是验证菠菜中含有碳酸盐,选用稀盐酸溶解沉淀,方法是:加入足量1 mol?L-1 HCl,将产生的气体通入足量澄清石灰水中,现象是沉淀溶解,澄清石灰水变浑浊,说明菠菜中含有碳酸盐;步骤3操作目的是验证草酸盐的存在,利用草酸盐具有还原性,方法是;向步骤2得到的溶液中滴加几滴0.01 mol?L-1 KMnO4,现象是溶液紫红色褪去,说明菠菜中含有草酸盐,
故答案为:至少含有C2O42-、CO32-中的一种或两种皆有;澄清石灰水变浑浊,说有菠菜中含有CO32-;高锰酸钾紫色褪去,说明菠菜中含有C2O42-;
(3)①配制250mL溶液应选用250mL容量瓶;KMnO4标准溶液与C2O42-反应生成+2价锰离子、二氧化碳和水,离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O,故答案为:250mL容量瓶;2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
②计算:根据反应方程式得关系式:5C2O42-~2KMnO4,代入题给数据则草酸盐中草酸根的质量为:
×10×10-3×88g=0.022Vg,所以菠菜中草酸盐(以C2O42-计算)的质量分数为
×100%=
×100%,故答案为:=
×100%;
③A.配制溶液时未洗涤烧杯和玻璃棒就加水定容,高锰酸钾溶液的体积偏小,测定结果偏低,故A错误;
B.锥形瓶未干燥就加入待测液进行滴定,对测定结果无影响,故B错误;
C.未用标准液润洗就加入标准液开始滴定,高锰酸钾溶液的体积偏大,测定结果偏高,故C正确;
D.滴定前尖嘴处有气泡滴定后气泡消失,高锰酸钾溶液的体积偏大,测定结果偏高,故D正确;
E.滴定后俯视读数,高锰酸钾溶液的体积偏小,测定结果偏低,故E错误;
故选:CD.
(2)草酸钙和碳酸钙均为不溶于水的白色固体,步骤1中出现白色沉淀,说明菠菜中至少含有C2O42-、CO32-中的一种或两种皆有;步骤2的目的是验证菠菜中含有碳酸盐,选用稀盐酸溶解沉淀,方法是:加入足量1 mol?L-1 HCl,将产生的气体通入足量澄清石灰水中,现象是沉淀溶解,澄清石灰水变浑浊,说明菠菜中含有碳酸盐;步骤3操作目的是验证草酸盐的存在,利用草酸盐具有还原性,方法是;向步骤2得到的溶液中滴加几滴0.01 mol?L-1 KMnO4,现象是溶液紫红色褪去,说明菠菜中含有草酸盐,
故答案为:至少含有C2O42-、CO32-中的一种或两种皆有;澄清石灰水变浑浊,说有菠菜中含有CO32-;高锰酸钾紫色褪去,说明菠菜中含有C2O42-;
(3)①配制250mL溶液应选用250mL容量瓶;KMnO4标准溶液与C2O42-反应生成+2价锰离子、二氧化碳和水,离子方程式为2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O,故答案为:250mL容量瓶;2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O;
②计算:根据反应方程式得关系式:5C2O42-~2KMnO4,代入题给数据则草酸盐中草酸根的质量为:
| 0.01V×5 |
| 2 |
| 0.022Vg |
| mg |
| 0.022V |
| m |
| 0.022V |
| m |
③A.配制溶液时未洗涤烧杯和玻璃棒就加水定容,高锰酸钾溶液的体积偏小,测定结果偏低,故A错误;
B.锥形瓶未干燥就加入待测液进行滴定,对测定结果无影响,故B错误;
C.未用标准液润洗就加入标准液开始滴定,高锰酸钾溶液的体积偏大,测定结果偏高,故C正确;
D.滴定前尖嘴处有气泡滴定后气泡消失,高锰酸钾溶液的体积偏大,测定结果偏高,故D正确;
E.滴定后俯视读数,高锰酸钾溶液的体积偏小,测定结果偏低,故E错误;
故选:CD.
点评:本题考查了物质性质的实验设计和实验分析判断,定量测定实验的设计和计算应用,掌握实验基础和物质性质是解题关键,题目难度中等.

练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
下列对实验现象的解释与结论正确的是( )
| A、除去SO2中少量HCl的方法是:将混合气体通过盛有NaHSO3饱和溶液的洗气瓶 |
| B、用蘸有浓氨水的玻璃棒置于某无机酸浓溶液的试剂瓶口,有大量白烟,说明该无机酸一定为盐酸 |
| C、向铜和稀硫酸的混合物中加入无色溶液,溶液逐渐变成蓝色,铜逐渐溶解,则该无色溶液一定是硝酸 |
| D、向某溶液中加入2滴KSCN溶液,溶液不显红色.再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+ |
把500ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、10(b-2a) mol?L-1 |
 对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )| A、增大b的浓度 | B、升高温度 |
| C、加入催化剂 | D、增大压强 |