题目内容
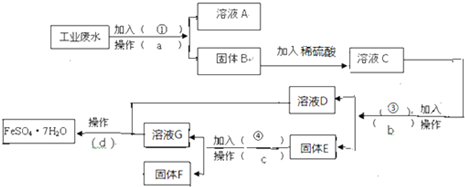
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有
与水反应.该反应的离子方程式为 ,在上述平衡体系中加入少量NaOH固体,溶液中Cl-浓度 (选填“增大”、“减小”或“不变”).
| 1 |
| 3 |
考点:氯气的化学性质
专题:卤族元素
分析:氯气与水反应生成盐酸和次氯酸,次氯酸是弱电解质;加入氢氧化钠,溶液中的氢氧根离子,和氢离子反应,平衡正向进行.
解答:
解:氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O?H++Cl-+HClO;在上述平衡体系中加入少量NaOH固体,会和平衡状态下的氢离子反应,平衡正向进行,溶液中Cl-浓度增大,
故答案为:Cl2+H2O?H++Cl-+HClO;增大.
故答案为:Cl2+H2O?H++Cl-+HClO;增大.
点评:本题考查了氯气性质,侧重于化学平衡的影响因素影响,Cl2溶于水的离子反应方程式的考查,为高频考点,侧重于浓度对反应平衡的移动影响,难度不大.

练习册系列答案
 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目
把500ml含有BaCl2和KCl的混合溶液分成5等份,取一份加入含amol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含bmol硝酸银的溶液,恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.3mol/L |
| D、10(b-2a) mol?L-1 |
洋蓟属高档蔬菜,从洋蓟提取的物质A具有良好的保健功能和药用价值,A在酸性条件下水解可生成B和C,反应可表示为下列说法不正确的是( )
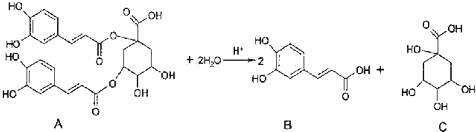

| A、A在一定条件下能发生取代反应、加成反应和消去反应 |
| B、1mol A和足量NaOH溶液反应,最多消耗11molNaOH |
| C、B能和浓溴水发生反应,1mol B最多消耗4 molBr2 |
| D、C分子中含有手性碳原子 |
 对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )
对可逆反应:A(g)+B(g)?2C(g)+D(g)△H<0,根 据图,从a反应历程改变为b反应历程,所采取的措施是( )| A、增大b的浓度 | B、升高温度 |
| C、加入催化剂 | D、增大压强 |
已知有机反应RH+Cl2(气)
RCl(液)+HCl(气),若在农药和有机合成工业中将HCl转化副产品盐酸,则从上述反应产物中分离得到盐酸的最佳方法是( )
| 光 |
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |