题目内容
6.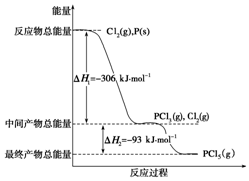 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:PCl5分解成PCl3和Cl2的热化学方程式是PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1.
(1)上述分解反应是一个可逆反应.压强P1时,在密闭容器中加入0.80mol PCl5,反应达到平衡时PCl5还剩0.60mol,其分解率α1等于25%;若体系压强由P1升高到P2,平衡时PCl5的分解率为α2,α2小于α1(填“大于”、“小于”或“等于”).
(3)P和Cl2分两步反应生成1mol PCl5的△H3=-399kJ•mol-1.
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是PCl5+4H2O═H3PO4+5HCl.
分析 (1)根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用;
(2)α1=$\frac{{n}_{反}}{{n}_{原}}×100%$进行计算;增大压强,平衡逆向移动,PCl5的分解率变小;
(3)根据盖斯定律分析,根据反应物的总能量、中间产物的总能量以及最终产物的总能量,结合化学方程式以及热化学方程式的书写方法解答,注意盖斯定律的应用;
(4)PCl5与足量水充分反应,最终生成磷酸和盐酸.
解答 解:(1)由图象可知,1molPCl5分解成PCl3和Cl2需要吸收93kJ的能量,则反应的热化学方程式为PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1,
故答案为:PCl5(g)═PCl3(g)+Cl2(g)△H=+93kJ•mol-1;
(2)α1=$\frac{{n}_{反}}{{n}_{原}}×100%$=$\frac{0.8mol-0.6mol}{0.8mol}$×100%=25%;热化学方程式:PCl5(g)=PCl3(g)+Cl2(g)△H=+93 kJ/mol,增大压强,平衡逆向移动,PCl5的分解率变小,故α2 小于α1,
故答案为:25%;小于;
(3)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的△H应该是相等的,P和Cl2分两步反应生成1 molPCl5的热化学方程式:
P(s)+32Cl2(g)═PCl3(g)△H1=-306 kJ/mol,
Cl2(g)+PCl3(g)═PCl5(g)△H2=-93 kJ/mol;
P和Cl2一步反应生成1molPCl5的△H3=-306 kJ/mol+(-93 kJ/mol)=-399 kJ/mol,
由图象可知,P和Cl2分两步反应生成1molPCl5的△H3=-306kJ/mol-(+93kJ/mol)=399kJ/mol,
故答案为:-399kJ•mol-1;
(4)PCl5与足量水充分反应,最终生成两种酸:磷酸和盐酸,由原子守恒可知化学方程式为PCl5+4H2O═H3PO4+5HCl,
故答案为:PCl5+4H2O═H3PO4+5HCl.
点评 本题考查较为综合,多角度考查反应热和化学方程式的书写、外界条件对化学平衡移动的影响及反应热的计算等知识,为高考常见题型,侧重于学生的分析、计算能力的考查,题目难度中等.

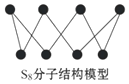
| A. | S2、S4、S6、S8互为同位素 | |
| B. | S2的摩尔质量为32 g/mol | |
| C. | 硫的单质在足量的空气中完全燃烧可生成SO3 | |
| D. | 1 mol S8单质中含有的S-S键个数为8NA |
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的平衡浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
| A. | 2c1>c3 | B. | a+b=92.4 | C. | 2p2>p3 | D. | α1+α3<1 |
| A. | 氧化镁熔点高,可用于制造耐高温材料 | |
| B. | 次氯酸有酸性,可用于自来水的杀菌消毒 | |
| C. | 油脂在碱性条件下水解,可用于制硬化油 | |
| D. | 晶体硅熔点高、硬度大,可用于制作半导体材料 |

 的名称为2,2,6-三甲基-4-乙基辛烷.
的名称为2,2,6-三甲基-4-乙基辛烷. 的名称为3-甲基-2-乙基-1-戊烯.
的名称为3-甲基-2-乙基-1-戊烯.
 .
.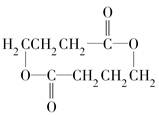 +2H2O.
+2H2O.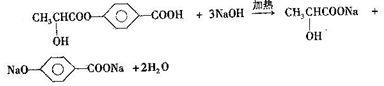 .
.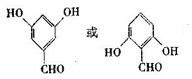 .
.