题目内容
18.一定温度下,在3个体积均为1.0L的恒容密闭容器中反应2H2(g)+CO(g)?CH3OH(g)达到平衡,下列说法正确的是( )| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该反应的正反应放热 | |
| B. | 达到平衡时,容器I中反应物转化率比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的正反应速率比容器I中的大 |
分析 对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式可知,增大浓度,平衡正向移动,以此解答该题.
解答 解:A.对比Ⅰ、Ⅲ,如温度相同,0.1mol/L的CH3OH相当于0.20mol/L的H2和0.1mol/L的CO,为等效平衡,但Ⅲ温度较高,平衡时CH3OH较低,说明升高温度平衡逆向移动,正反应为放热反应,故A正确;
B.对比Ⅰ、Ⅱ,在相同温度下反应,但Ⅱ浓度较大,由方程式2H2(g)+CO(g)?CH3OH(g)可知,增大浓度,平衡正向移动,该反应正向为体积减小的反应,增大浓度转化率会增大,则容器Ⅰ中反应物转化率比容器Ⅱ中的小,故B错误;
C.Ⅱ浓度较大,Ⅲ温度较高,增大浓度平衡正向移动,升高温度平衡逆向移动,Ⅲ的转化率降低,Ⅲ中相当于起始C(H2)为Ⅱ的一半,平衡时Ⅱ中C(H2)小于Ⅲ中的两倍,故C错误;
D.对比Ⅰ、Ⅲ,Ⅲ温度较高,浓度相当,升高温度,正逆反应速率增大,则容器Ⅲ中的反应速率比容器Ⅰ中的大,故D正确.
故选AD.
点评 本题考查了化学平衡的有关计算、化学反应速率的影响,涉及等效平衡问题,侧重于学生的分析能力的考查,题目难度中等,答题时注意把握反应的特点以及平衡的影响因素.

练习册系列答案
相关题目
4.下列关于有机物的说法正确的是( )
| A. | 糖类和蛋白质都属于高分子化合物 | B. | 苯和聚乙烯均能发生加成反应 | ||
| C. | C5H11Cl有6种同分异构体 | D. | 石油分馏、煤干馏都可得到烃 |
5.下列大小比较不正确的是( )
| A. | 熔沸点:S<NaCl<SiO2 | |
| B. | 酸性:HNO2<HNO3;H3PO4<H2SO4 | |
| C. | 键角:H2O中H-O-H<NH3中H-N-H<CH4中H-C-H | |
| D. | 键长:C-H<O-H |
13.火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态N2O4.已知:①2O2(g)+N2(g)=N2O4(l)△H1 ②N2(g)+2H2(g)=N2H4(l)△H2 ③O2(g)+2H2(g)=2H2O(g)△H3
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol
(1)上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态N2O4反应生成液态水时放出的热量是612kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(4)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+2H2O(g)?CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如表所示:
试通过计算得出该反应的△H=+162 kJ/mol.
④2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H4=-1048kJ/mol
(1)上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态N2O4反应生成液态水时放出的热量是612kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是产物不会造成环境污染.
(4)合成氨工业中氢气可由天然气和水反应制备,其主要反应为:
CH4(g)+2H2O(g)?CO2(g)+4H2(g) 已知,破坏1mol化学键需要吸收的热量如表所示:
| 化学键 | C-H | O-H | C=O | H-H |
| 吸收热量(kJ/mol) | 414 | 464 | 803 | 436 |
3.工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量小于(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量.
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41kJ/mol
某小组研究在相同温度下该反应过程中的能量变化.他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应.相关数据如表:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(2)容器①中反应达平衡时,CO的转化率为80%.
(3)计算容器①中反应的平衡常数K=1.某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正小于V逆(填大于,小于或等于)
(4)下列叙述正确的是ad(填字母序号).
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q>65.6kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)△H=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式:2CO(g)+O2(g)═2CO2(g)△H=-566KJ/mol.
7.下列关于元素性质的有关叙述中不正确的是( )
| A. | S Cl 的原子半径依次减小 | |
| B. | Na Mg 的失电子能力依次增强 | |
| C. | O F的气态氢化物的稳定性依次增强 | |
| D. | Si P 的最高价含氧酸的酸性依次增强 |
8.几种短周期元素的原子半径及主要化合价如表:已知X是短周期中最活泼的金属,且与R同周期.(请用化学用语答题)
(1)R的元素符号为Al; M在元素周期表中的位置为第二周期第VIA族.
(2)X与Y按原子个数比1:1构成的物质的电子式为 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.
(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
(2)X与Y按原子个数比1:1构成的物质的电子式为
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.(3)X+,Y2?,M2?离子半径大小顺序为S2?>O2?>Na+;.
(4)将YM2通入FeCl3溶液中的离子方程式2H2O+SO2+2Fe3+=2Fe2++SO42-+4H+.
(5)用Cu单质作阳极,石墨作阴极,X的最高价氧化物对应的水化物溶液作电解液进行电解,写出阳极的反应式Cu+2OH--2e-=Cu(OH)2.
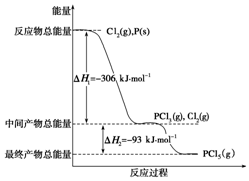 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题:
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).根据图回答下列问题: