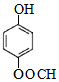
题目内容
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 78gNa2O2固体中阴离子的个数为2NA | |
| B. | Na2O2与H2O反应生成1.12L(标准状况)气体,反应中转移的电子数为0.2NA | |
| C. | 1mol氯气溶于足量水中,转移的电子数为NA | |
| D. | 在1 L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA |
分析 A.过氧化钠中阴离子为过氧根离子;
B.过氧化钠与水反应为歧化反应,过氧化钠中氧元素的化合价为-1价,根据氧气的物质的量计算出转移的电子数;
C.氯气与水反应为可逆反应,依据可逆反应不能进行到底特点解答;
D.碳酸根离子水解生成碳酸氢根离子、氢氧根离子.
解答 解:A.78gNa2O2固体物质的量为:$\frac{78g}{78g/mol}$=1mol,含有阴离子的个数为1NA,故A错误;
B.标准状况下,1.12L氧气的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,过氧化钠与水反应生成0.05mol氧气,转移了0.1mol电子,转移的电子数为0.1NA,故B错误;
C.氯气与水反应为可逆反应,可逆反应不能进行到底,所以1mol氯气溶于足量水中,转移的电子数小于NA,故C错误;
D.碳酸根离子水解生成碳酸氢根离子、氢氧根离子,所以在1 L0.1mol/L碳酸钠溶液中,阴离子总数大于0.1NA,故D正确;
故选:D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意盐类水解规律.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
6. 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
(1)①由上表数据可知该反应为放热 (填放热,吸热,无法确定 )反应.
②下列措施能用勒夏特列原理解释是ad.(填序号)
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应
式NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1.
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合
氨的电离平衡常数Kb=$\frac{1{0}^{-7}b}{a-b}$.(用ab表示)
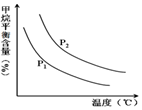
(4)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2
(填“>”、“=”或“<”).
②其它条件一定,升高温度,氢气的产率会增大.(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
 合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:| 温 度(℃) | 360 | 440 | 520 |
| K值 | 0.036 | 0.010 | 0.0038 |
②下列措施能用勒夏特列原理解释是ad.(填序号)
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应
式NH3.H2O(aq)+H2SO4(aq)=NH4HSO4(aq)+H2O(l)△H=-5Q kJ•mol-1.
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl-),则一水合
氨的电离平衡常数Kb=$\frac{1{0}^{-7}b}{a-b}$.(用ab表示)
(4)原料气H2可通过反应 CH4(g)+H2O (g)?CO(g)+3H2(g) 获取,已知该反应中,当初始混合气
中的$\frac{n({H}_{2}O)}{n(C{H}_{4})}$恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
①图中,两条曲线表示压强的关系是:P1<P2
(填“>”、“=”或“<”).
②其它条件一定,升高温度,氢气的产率会增大.(填“增大”,“减小”减小,“不变”不变)
(5)原料气H2还可通过反应CO(g)+H2O(g)?CO2 (g)+H2(g) 获取.
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08mol•L-1,该温度下反应的平衡常数K值为2.25.
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是cd(填序号).
a.容器内压强不随时间改变 b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6.
3.下列离子方程式书写正确是( )
| A. | 氯化亚铁溶液中加入稀硝酸:3Fe2++4H++NO 3-═3Fe 3++2H2O+NO↑ | |
| B. | 氧化亚铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| C. | 固体氯化钠与浓硫酸混合加热:H 2SO 4+2Cl-═SO 2↑+Cl 2↑+H 2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
10.化学与生产、生活密切相关.下列说法正确的是( )
| A. | 天津港爆炸事故救援过程中,消防员若发现存放金属钠、电石、甲苯二异氰酸酯等化学品的仓库起火,应立即用泡沫灭火器将火扑灭 | |
| B. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧,说“纳米铜”的还原性比铜片更强 |
7.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 80 mL10 mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 通入了1 mol Cl2的新制氯水中,HC1O、Cl-、C1O-粒子数之和为2NA | |
| C. | 1 mol Na2O2中含有的阴离子数为2 NA | |
| D. | 标准状况下,4.48L NH3中共用电子对数为0.6 NA |
4.如图为二维平面晶体示意图,对a、b晶体示意图所表示的化学式说法正确的是( )

| A. | a为A2X3,b为AX3 | B. | a为AX3,b为AX2 | C. | a为AX2,b为AX3 | D. | a为AX3,b为A2X3 |
12. 常温下,浓度均为0.100mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,其滴定曲线如图所示:当两溶液中均滴入相同体积的HCl溶液时,相应的两溶液中微粒的物质的量浓度关系一定正确的是( )
常温下,浓度均为0.100mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,其滴定曲线如图所示:当两溶液中均滴入相同体积的HCl溶液时,相应的两溶液中微粒的物质的量浓度关系一定正确的是( )
 常温下,浓度均为0.100mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,其滴定曲线如图所示:当两溶液中均滴入相同体积的HCl溶液时,相应的两溶液中微粒的物质的量浓度关系一定正确的是( )
常温下,浓度均为0.100mol•L-1、体积均为15.00mL的氨水和NaHCO3溶液分别用0.100mol•L-1HCl溶液滴定,其滴定曲线如图所示:当两溶液中均滴入相同体积的HCl溶液时,相应的两溶液中微粒的物质的量浓度关系一定正确的是( )| A. | 当V(HCl)=0 mL时,c(NH3•H2O)=c(HCO3-) | |
| B. | 当V(HCl)=4.00 mL时,c(NH4+)>c(NH3•H2O)>c(HCO3-)>c(CO32-) | |
| C. | 当V(HCl)=8.00 mL时,c(Na+)<c(NH4+)+c(HCO3-)+2c(CO32-) | |
| D. | 当V(HCl)=15.00 mL时,c(Na+)=c(NH4+)+c(NH3•H2O) |
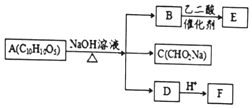 某芳香化合物A有如下转化:
某芳香化合物A有如下转化: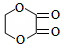 1mol F 最多消耗2mol NaOH.
1mol F 最多消耗2mol NaOH.