题目内容
17.将5克某金属加入到100mL的4mol/L的硫酸中,当硫酸的浓度降至原浓度的一半时(设溶液体积不变),金属还没全部溶解完,该金属可能是( )| A. | Al | B. | Zn | C. | Fe | D. | Mg |
分析 稀硫酸浓度降低,说明金属与稀硫酸反应生成氢气,令金属的相对原子质量为a、反应中化合价为b,消耗一般硫酸时金属有剩余,根据电子转移守恒列不等式,结合选项讨论确定,注意钠能够与水反应.
解答 解:参加反应的硫酸物质的量=0.1L×4mol/L×$\frac{1}{2}$=0.2mol,设金属的相对原子质量为a、反应中化合价为b,金属还没有全部溶解,根据电子转移守可知:$\frac{5}{a}$×b>0.2×2,整理可得:a<12.5b,
A.反应中Al为+3价,则a=$\frac{5×3}{0.4}$=37.5,故A符合;
B.反应中Zn为+2价,则a=25<$\frac{5×2}{0.2}$=50,故B不符合;
C.反应中Fe为+2价,则a=25<$\frac{5×2}{0.2}$=50,故C不符合;
D.反应中Mg为+2价,则a=24<$\frac{5×2}{0.2}$=50,故D不符合;
故选A.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意利用电子转移守恒方法简化计算,转移讨论法的利用.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案
相关题目
7.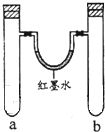 某化学小组用以下装置做兴趣实验(试管中有空气存在).
某化学小组用以下装置做兴趣实验(试管中有空气存在).
(1)实验1,同时加入试剂,反应开始可观察到U形管中液面b(填编号),简述产生该现象的原因钠与水反应比钠与乙醇反应快,所以开始时a试管中产生的氢气比b试管多,故液面应左低右高.
a.左高右低b.左低右高c.左右相平d.来回震荡
(2)写出钠与乙醇反应的化学方程式2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;反应结束静置一段时间,最终U形管中液面c(填题(1)编号).
(3)实验2,U形管中液面a(填题(1)编号);写出a试管中发生还原反应的电极反应方程式O2+2H2O+4e→4OH-.
(4)实验3,U形管中液面左低右高,检验b管中生成新物质的操作是取样,加入KSCN溶液,溶液变红,说明有Fe3+生成.
(5)其他条件不变情况下,将实验4a、b试管中硝酸同时改为3mLcd(填编号),即可观察到U形管液面产生相反现象.
a.无水乙醇b.浓硫酸c.稀硫酸d.浓盐酸
(6)常温下,在a、b试管中分别加入等体积的同种溶液,仅对a试管进行强光照射,一段时间后观察到U型管液面左低右高,根据所学知识,推测该溶液为氯水(写名称).
 某化学小组用以下装置做兴趣实验(试管中有空气存在).
某化学小组用以下装置做兴趣实验(试管中有空气存在).| 实验编号 | a中试剂 | b中试剂 |
| 1 | 0.1克Na、3mL水 | 0.1克Na、3mL乙醇 |
| 2 | 铁钉、3mL饱和食盐水 | 铁钉、3mL饱和氯化铵 |
| 3 | 3mL水 | 3mL饱和FeSO4溶液 |
| 4 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 |
a.左高右低b.左低右高c.左右相平d.来回震荡
(2)写出钠与乙醇反应的化学方程式2CH3CH2OH+2Na→2CH3CH2ONa+H2↑;反应结束静置一段时间,最终U形管中液面c(填题(1)编号).
(3)实验2,U形管中液面a(填题(1)编号);写出a试管中发生还原反应的电极反应方程式O2+2H2O+4e→4OH-.
(4)实验3,U形管中液面左低右高,检验b管中生成新物质的操作是取样,加入KSCN溶液,溶液变红,说明有Fe3+生成.
(5)其他条件不变情况下,将实验4a、b试管中硝酸同时改为3mLcd(填编号),即可观察到U形管液面产生相反现象.
a.无水乙醇b.浓硫酸c.稀硫酸d.浓盐酸
(6)常温下,在a、b试管中分别加入等体积的同种溶液,仅对a试管进行强光照射,一段时间后观察到U型管液面左低右高,根据所学知识,推测该溶液为氯水(写名称).
12.电解饱和食盐水时,先精制盐水以除去SO42-、Mg2+、Ca2+,依次加入的溶液是( )
| A. | NaOH、BaCl2、Na2CO3、HCl | B. | BaCl2、HCl、Na2CO3、NaOH | ||
| C. | BaCl2、Na2CO3、HCl、NaOH | D. | Na2CO3、NaOH、BaCl2、HCl |
2.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1 L 1 mol•L-1 K2SO4溶液中含有的钾离子数为2NA | |
| B. | 1mol氯气完全反应生成氯离子得到的电子数为NA | |
| C. | 22 g CO2中含有的分子数为NA | |
| D. | 常温常压下,22.4 L N2中含有的分子数为NA |
9.气体的体积主要由什么因素决定的( )
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
①气体分子的大小 ②气体分子数的多少 ③气体分子间的平均距离④气体分子的相对分子质量.
| A. | ①② | B. | ①③ | C. | ②③ | D. | ②④ |
19.核外电子是分层排布的,原子核外有K、L、M、N、O、P、Q等电子层,K电子层和L电子层最多容纳的电子数的关系是( )
| A. | K层多 | B. | L层多 | C. | 相等 | D. | 不能确定 |
 H2O的结构式H-O-H.
H2O的结构式H-O-H.
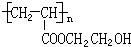 .
.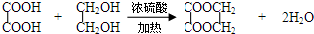 .
.
