题目内容
0.01mol?L-1NaOH溶液中的c(H+)是0.0005mol?L-1Ba(OH)2溶液中c(H+)的( )
| A、10倍 | ||
| B、20倍 | ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:计算NaOH溶液、Ba(OH)2溶液中溶液中c(OH-),再根据水的离子积计算溶液中c(H+),进而计算两溶液中c(H+)倍数.
解答:
解:0.01mol?L-1NaOH溶液中c(OH-)=0.01mol/L,溶液中c(H+)=
mol/L=10-12mol/L,
0.0005mol?L-1Ba(OH)2溶液中c(OH-)=2×0.0005mol/L=0.001mol/L,溶液中c(H+)=
mol/L=10-11mol/L,
故NaOH溶液中的c(H+)是Ba(OH)2溶液中c(H+)的
=
倍,
故选C.
| 10-14 |
| 0.01 |
0.0005mol?L-1Ba(OH)2溶液中c(OH-)=2×0.0005mol/L=0.001mol/L,溶液中c(H+)=
| 10-14 |
| 0.001 |
故NaOH溶液中的c(H+)是Ba(OH)2溶液中c(H+)的
| 10-12mol/L |
| 10-11mol/L |
| 1 |
| 10 |
故选C.
点评:本题考查水的离子积有关计算,比较基础,注意对水的离子积的理解掌握.

练习册系列答案
相关题目
下列关于分散系的叙述不正确的是( )
A、分散系的分类: |
| B、用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 |
| C、把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 |
D、 如图所示是树林中的晨曙,该反应与丁达尔效应有关 如图所示是树林中的晨曙,该反应与丁达尔效应有关 |
一种新型燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通过乙烷和氧气,其电极反应式:C2H6+18OH--14e-=2CO32-+12H2O,7H2O+
O2+14e-=14OH-,有关此电池的推断正确的是( )
| 7 |
| 2 |
| A、通乙烷的电极为正极 |
| B、参加反应的O2与C2H6的物质的量比为7:2 |
| C、放电一段时间后,KOH的物质的量浓度不变 |
| D、电解质溶液中,CO32-向正极移动 |
下列有关化学用语使用正确的是( )
| A、乙酸、葡萄糖、淀粉的最简式均为CH2O |
B、羧基的电子式为 |
C、乙醇分子的比例模型为 |
D、2-羧基丁酸的键线式为 |
设NA为阿伏伽德罗常数.下列叙述正确的是( )
| A、20mL10mol?L-1浓硫酸或浓硝酸与足量铜加热反应转移电子数均为0.2NA |
| B、0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C、标准状况下,2.24L CI2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
| D、在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数为NA |

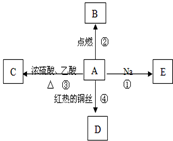 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.B物质中含有碳元素.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.B物质中含有碳元素.