题目内容
气态烃A是来自石油的一种基本化工原料,B和C是生活中两种常见的有机物.以A为主要原料合成乙酸乙酯,其合成路线如图所示.

(1)A分子的结构简式是 ;
(2)在反应①~③中属于加成反应的是 ,属于取代反应的是 ;
(3)可用于鉴别B、C的一种试剂是 .
(4)乙酸乙酯的同类别同分异构体有 种,写出其中一种同分异构体的结构简式 .

(1)A分子的结构简式是
(2)在反应①~③中属于加成反应的是
(3)可用于鉴别B、C的一种试剂是
(4)乙酸乙酯的同类别同分异构体有
考点:有机物的推断
专题:有机物的化学性质及推断
分析:B和C反应生成乙酸乙酯,B氧化生成C,故B为CH3CH2OH,C为CH3COOH,A与水反应生成CH3CH2OH,故A为乙烯,据此解答.
解答:
解:B和C反应生成乙酸乙酯,B氧化生成C,故B为CH3CH2OH,C为CH3COOH,A与水反应生成CH3CH2OH,故A为乙烯,
(1)A是乙烯,结构式为CH2=CH2,
故答案为:CH2=CH2;
(2)在反应①~③中,反应①是乙烯的水化,是加成反应,反应②是醇的氧化,是氧化反应,反应③是酯化反应,是取代反应,
故答案为:①;③;
(3)B为CH3CH2OH,C为CH3COOH,可以利用紫色石蕊试液鉴别它们,
故答案为:紫色石蕊试液;
(4)属于酯类的乙酸乙酯的同类别同分异构体有CH3COOCH2CH3、HCOOCH2CH2CH3、HCOOCH(CH3)2,共3 种,其中一种同分异构体的结构简式为CH3COOCH2CH3或HCOOCH2CH2CH3或HCOOCH(CH3)2,
故答案为:CH3COOCH2CH3或HCOOCH2CH2CH3或HCOOCH(CH3)2;
(1)A是乙烯,结构式为CH2=CH2,
故答案为:CH2=CH2;
(2)在反应①~③中,反应①是乙烯的水化,是加成反应,反应②是醇的氧化,是氧化反应,反应③是酯化反应,是取代反应,
故答案为:①;③;
(3)B为CH3CH2OH,C为CH3COOH,可以利用紫色石蕊试液鉴别它们,
故答案为:紫色石蕊试液;
(4)属于酯类的乙酸乙酯的同类别同分异构体有CH3COOCH2CH3、HCOOCH2CH2CH3、HCOOCH(CH3)2,共3 种,其中一种同分异构体的结构简式为CH3COOCH2CH3或HCOOCH2CH2CH3或HCOOCH(CH3)2,
故答案为:CH3COOCH2CH3或HCOOCH2CH2CH3或HCOOCH(CH3)2;
点评:本题考查有机物的推断,涉及烯烃、醇、羧酸的性质与转化,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目
下列物质是强电解质是( )
| A、氧化铝 | B、晶体硅 |
| C、盐酸 | D、氨水 |
0.01mol?L-1NaOH溶液中的c(H+)是0.0005mol?L-1Ba(OH)2溶液中c(H+)的( )
| A、10倍 | ||
| B、20倍 | ||
C、
| ||
D、
|
下列表达式正确的是( )
| A、氨水电离:NH3?H2O=NH4++OH- |
| B、碳酸钙电离:CaCO3?Ca2++CO32- |
| C、硫酸铝水解:Al3++2H2O=Al(OH)3↓+3OH- |
| D、AgCl的沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) |
将一定质量的Ag2SO4固体置于容积不变的密闭容器中(加入少量V2O5),在某温度时发生反应:Ag2SO4(s)?Ag2O(s)+SO3(g),2SO3(g)?2SO2(g)+O2(g).10min后反应达平衡,此时c(SO3)=0.4mol?L-1、c(SO2)=0.1mol?L-1,则下列叙述中不正确的是( )
| A、SO3的分解率为20% |
| B、10min内用O2表示的该反应的反应速率为0.005mol/(L?min) |
| C、容器内气体的密度为40g/L |
| D、达到平衡时分解的Ag2SO4固体为0.5mol |


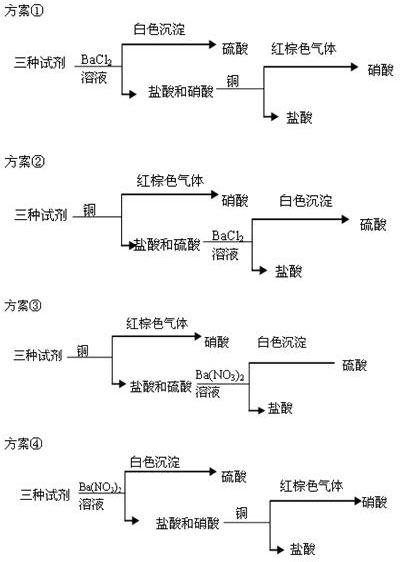
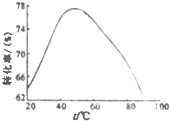 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下: