题目内容
15.NA是阿伏伽德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA | |
| B. | 58.5gNaCl晶体中含有NA个NaCl分子 | |
| C. | 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA | |
| D. | 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA |
分析 A.气体摩尔体积使用对象为气体;
B.氯化钠为离子晶体,不含分子;
C.依据Fe+2Fe3+=3Fe2+,生成3mol二价铁离子转移2mol电子;
D.镁离子、铝离子水溶液中部分水解.
解答 解:A.标况下,乙醇为液体,不能使用气体摩尔体积,故A错误;
B.氯化钠为离子晶体,不含分子,故B错误;
C.依据Fe+2Fe3+=3Fe2+,生成3mol二价铁离子转移2mol电子,则生成0.75molFeCl2,失去的电子数为0.5 NA,故C正确;
D.镁离子、铝离子水溶液中部分水解,所以100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目大于0.05NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大,注意只有分子晶体中含有分子.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案
相关题目
5.下列不能用勒夏特列原理解释的是( )
| A. | 热的纯碱溶液去油污效果好 | |
| B. | 新制的氯水在光照条件下颜色变浅 | |
| C. | 收集氯气用排饱和食盐水的方法 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
3.下列说法不正确的是( )
| A. | 苯和甲苯分子中所有原子均在同一平面上 | |
| B. | 苯不可以使KMnO4酸性溶液褪色而甲苯可以 | |
| C. | 苯和甲苯都能与卤素单质、硝酸等发生取代反应 | |
| D. | 苯的同系物的分子通式是CnH2n-6(n≥7) |
10.在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目变化最小的是( )
| A. | Na+ | B. | Al3+ | C. | Fe2+ | D. | Fe3+ |
20.下列反应的离子方程式书写正确的是( )
| A. | 氯气溶于水:Cl2+H2O═Cl-+ClO-+2H+ | |
| B. | 金属钠加入稀硫酸中:Na+2H+═Na++H2↑ | |
| C. | 明矾溶液中加入足量Ba(OH)2溶液:SO42-+Al3++Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 向含有稀盐酸的氯化亚铁溶液中通入氧气:4Fe2++O2+4H+═4 Fe3++2H2O |
7.物质的检验、鉴别要特别注意到共存物质的干扰,否则得到的结论就是不可靠的,例如,实验室用乙醇、浓硫酸在170℃时制得的CH2=CH2 中混有SO2,用溴水或酸性KMnO4溶液检验生成的CH2=CH2时,就要考 虑到SO2 的影响,因为SO2也能使溴水或酸性KMnO4溶液褪色,所以检验有CH2=CH2生成就需先除去SO2.下列实验设计所得结论可靠的是( )
| A. | 将电石与水反应产生的气体通入酸性KMnO4溶液中,溶液褪色说明有乙炔生成 | |
| B. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到酸性KMnO4溶液中,溶液褪色说明有CH2=CH2生成 | |
| C. | 将溴乙烷与NaOH 的乙醇溶液共热产生的气体通入到溴水中,溴水褪色,说明有乙烯生成 | |
| D. | 将苯、液溴、铁粉混合物反应产生的气体通入到AgNO3溶液中有淡黄色沉淀产生,说明有HBr 生成 |
4.天津港“8.12”特大火灾爆炸事故,造成了极其恶劣的社会影响.原因是化学危险品随意堆放,管理人员安全意识淡漠,对人民的生命财产极不负责任.
下面是其中一部分危险品.请回答下列问题:
(1)写出过氧化氢的电子式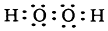
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
下面是其中一部分危险品.请回答下列问题:
硝酸铵 | 过氧化钠 高锰酸钾 氯酸钾 |
钠 钙 过氧化氢 | 氧化钠 |
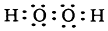
(2)上述危险品中,和水反应且符合下列条件的离子方程式2Na2O2+2H2O=4Na++4OH-+O2
①属于氧化还原反应 ②水既不做氧化剂也不做还原剂
(3)400℃时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式4NH4NO3=3N2↑+2NO2↑+8H2O△H=-16QkJ/mol
(4)写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O
(5)氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒.氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是CN-+H2O2+H2O═HCO3-+NH3↑
调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水2.38×106L.
5.只用试管和胶头滴管而不用其他试剂无法鉴别的溶液是( )
| A. | AlCl3溶液和NaOH溶液 | B. | Na2CO3溶液和盐酸 | ||
| C. | NaAlO2溶液和盐酸 | D. | Al2(SO4)3溶液和氨水 |