题目内容
6.电解饱和食盐水时收集标况下氢气22.4L,问(1)反应掉的氯化钠的质量是多少?
(2)反应后溶液体积为1L,生成的氢氧化钠的物质的量浓度是多少?
分析 n(H2)=$\frac{22.4L}{22.4L/mol}$=1mol,结合电解饱和食盐水的化学方程式2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑解答该题.
解答 解:n(H2)=$\frac{22.4L}{22.4L/mol}$=1mol,化学方程式为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑,则
(1)由方程式可知生成1mol氢气,则消耗2molNaCl,m(NaCl)=2mol×58.5g/mol=117g,
答:反应掉的氯化钠的质量是117g;
(2)由方程式可知生成的n(NaOH)=2mol,体积为1L,
则c(NaOH)=$\frac{2mol}{1L}$=2mol/L.
答:反应后溶液体积为1L,生成的氢氧化钠的物质的量浓度是2mol/L.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生计算能力,会正确运用原子守恒及关系式,题目难度不大.

练习册系列答案
相关题目
17.测定胆矾晶体中结晶水含量的实验中,必须做恒重操作的原因是( )
| A. | 判定加热时有无晶体飞溅 | B. | 判断是否已失去全部结晶水 | ||
| C. | 判断是否有其他杂质 | D. | 防止失水后又吸潮 |
17.用NA表示阿伏伽德罗常数,下列叙述中正确的是( )
| A. | 12g 12C含中子数为NA | |
| B. | 标准状况下,22.4L氖气中含有原子数为2NA | |
| C. | 28g CO和N2混合气体含有的原子数为2NA | |
| D. | 2mol钠与足量O2完全反应生成Na2O2时失去电子数为NA |
14.下列药品中,具有解热镇痛作用,可用作治疗感冒的是( )
| A. | 阿司匹林 | B. | 青霉素 | C. | 麻黄碱 | D. | 抗酸药 |
18.化学与社会、生活密切相关.对下列现象或事实的解释不正确的是( )
| 选项 | 现象或事实 | 解释或对应的离子方程式 |
| A | 用热的纯碱溶液洗去油污 | Na2CO3可直接和油污反应 |
| B | 酸雨样品在空气中放置pH减小 | 亚硫酸被氧化为硫酸 2H2SO3+O2=2H2SO4 |
| C | “84”消毒液具有漂白性 | ClO-+CO2+H2O=HClO+HCO3- |
| D | 用加热法除去NaCl固体中混有的NH4Cl固体 | NH4Cl固体可以完全分解成为气体而除去 |
| A. | A | B. | B | C. | C | D. | D |
15.NA是阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2 LCH3CH2OH中含有分子的数目为0.5NA | |
| B. | 58.5gNaCl晶体中含有NA个NaCl分子 | |
| C. | 56g铁粉与一定量氯化铁溶液反应生成0.75molFeCl2,失去的电子数为0.5 NA | |
| D. | 100mL浓度均为0.2mol/L的MgCl2和AlCl3混合溶液中阴离子的数目为0.05NA |
16.某课外实验小组设计的下列实验不合理的是( )


| A. | 图1:制备并观察氢氧化亚铁 | B. | 图2:证明过氧化钠与水反应放热 | ||
| C. | 图3:收集二氧化氮气体 | D. | 图4:制备氨气 |


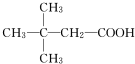 .(用结构简式表示)
.(用结构简式表示)