题目内容
12.实验室欲配制480mL0.2mol/L的NaOH溶液.(1)通过计算可知,应用托盘天平称量4.0克NaOH固体.
(2)本实验所需要的玻璃仪器除量筒、胶头滴管、烧杯、玻璃棒外还有500mL容量瓶.
(3)写出下列操作的正确顺序(填写相应的字母)D H B F A E CG.
A、洗涤 B、冷却 C、摇匀 D、称量 E、定容 F、转移溶液
G、倒入试剂瓶贴标签 H、溶解
(4)若在实验过程中出现如下情况,对所配溶液的浓度将会有何影响(选填“偏高”或“偏低”或“无影响”)?
①加蒸馏水不慎超过了刻度偏低
②容量瓶不干燥,有一定的水分无影响
③仰视观察到液面刚好到达刻度线偏低.
分析 (1)依据m=CVM计算需要溶质的质量;
(2)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,依据配制溶液体积选择需要容量瓶规格;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制480mL0.2mol/L的NaOH溶液,需要选择500mL容量瓶,实际配制500mL溶液,需要氢氧化钠的质量m=0.2mol/L×40g/mol××0.5L=4.0g;
故答案为:4.0;
(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制480mL0.2mol/L的NaOH溶液,应选择500mL容量瓶,所以还缺少的玻璃仪器:500ml容量瓶;
故答案为:500ml容量瓶;
(3)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀,所以正确的顺序为:D H B F A E C G;
故答案为:D H B F A E C G;
(4)①加蒸馏水不慎超过了刻度,导致溶液体积偏大,溶液浓度偏低;
②容量瓶不干燥,有一定的水分,对溶质的物质的量和溶液体积都不会产生影响,溶液浓度不变;
③仰视观察到液面刚好到达刻度线,导致溶液体积偏大,溶液浓度偏低;
故答案为:①偏低 ②无影响 ③偏低;
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意误差分析的方法,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列说法不正确的是( )
| A. | 外界条件相同时,放热反应的速率一定大于吸热反应的速率 | |
| B. | 化学反应中的能量变化可表现为热量的变化 | |
| C. | 反应物的总能量高于生成物的总能量时,发生放热反应 | |
| D. | CaO+H2O═Ca(OH)2反应过程中,旧键断裂吸收的能量小于新键形成释放的能量 |
4.已知25℃时,Ka(HF)=3.6×10-4,Ksp(CaF2)=1.46×10-10,Ksp(CaCO3)=2.8×10-9;现向1L 0.2mol•L-1 HF溶液中加入1L 0.2mol•L-1 CaCl2溶液.下列说法中正确的是( )
| A. | 该体系中HF与CaCl2反应产生沉淀 | |
| B. | 25℃时,CaF2比CaCO3的溶解度更小 | |
| C. | 25℃时,0.1 mol•L-1 HF溶液中pH<1 | |
| D. | Ksp(CaF2)随温度和浓度的变化而变化 |
17.某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
①可以判断该分解反应已经达到平衡的是BC.
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.
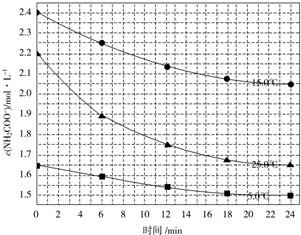
⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)?2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于如表:
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓 度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时的分解平衡常数:K=1.6×10-8(mol•L-1)3.
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25.0℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量增加 (填“增加”,“减少”或“不变”).
④氨基甲酸铵分解反应的焓变△H>0(填“>”、“=”或“<”),熵变△S>0(填“>”、“=”或“<”).
(2)已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图所示.

⑤计算25.0℃时,0~6min氨基甲酸铵水解反应的平均速率:0.05mol/(L•min).
⑥根据图中信息,如何说明该水解反应速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
1.下列化学方程式的书写正确的是( )
| A. | 硝酸见光分解:4HNO3$\frac{\underline{\;光照\;}}{\;}$4NO2↑+O2↑+2H2O | |
| B. | 往NaOH溶液中通入过量二氧化硫:2NaOH+SO2═Na2SO3+H2O | |
| C. | SO2气体通入BaCl2溶液中产生白色沉淀:SO2+BaCl2+H2O═BaSO3↓+2HCl | |
| D. | Fe与稀H2SO4反应的化学方程式为:2Fe+3H2SO4═Fe2(SO4)3+3H2↑ |
2.下列各组化合物中,化学键类型完全相同的是( )
| A. | Na2O2 和Na2O | B. | MgCl2 和Na2S | C. | CaO和CO2 | D. | HCl 和NaOH |




